
【题目】下列说法正确的是( )
A. 甲醇燃料电池工作时,甲醇得到电子,发生还原反应
B. 室温下,稀释0.1 mol·L-1氨水,c(H+)·c(NH3·H2O)的值减小
C. 将1 mol Cl2通入水中,HClO、Cl-、ClO-粒子数之和为2×6.02×1023
D. SiO2(s)+2C(s)===Si(s)+2CO(g)在常温下不能自发进行,则该反应的ΔH<0
【答案】B
【解析】
A. 甲醇燃料电池中,通入甲醇的电极是负极,负极上失电子发生氧化反应,故A错误;
B. 由NH3H2OOH-+NH4+可知,加水促进电离,因温度不变,则电离平衡常数不变,水的离子积也不变,Kb=![]() =
=![]() ,由于c(H+)和c(OH-)的乘积不变,而c(NH4+)减小,则c(H+)·c(NH3·H2O)的值减小,故B正确;
,由于c(H+)和c(OH-)的乘积不变,而c(NH4+)减小,则c(H+)·c(NH3·H2O)的值减小,故B正确;
C. 氯气和水的反应为可逆反应,不能进行彻底,故氯水中含未反应的氯气分子,即溶液中的HClO、Cl-、ClO-粒子数之和小于2×6.02×1023,故C错误;
D. △H-T△S>0,反应非自发进行,反应△S>0,满足△H-T△S>0,则△H>0,故D错误。
答案选B。


科目:高中化学 来源: 题型:
【题目】下列关于氯水的叙述中正确的是 ( )
A.新制氯水中只含有Cl2和H2O两种分子
B.新制氯水可以使蓝色石蕊试纸先变红后褪色
C.光照氯水有气泡逸出,逸出的气体是氯气
D.氯水放置数天后pH变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表第四周期Ⅷ族,其基态原子中未成对电子个数为___________。
(2)基态Fe3+的核外电子排布式___________
(3)铁氧体是一种磁性材料,工业上制备时常采用水解法,制备时常加入尿素(CO(NH2)2)、醋酸钠等碱性物质。尿素分子中所含非金属元素的电负性由大到小的顺序是___________,分子中σ键与π键的数目之比为___________。醋酸钠中碳原子的杂化类型___________。
(4)铁氧体也可使用沉淀法,制备时常加入氨(NH3)、联氨(N2H4)等弱碱,已知氨(NH3熔点:-77.8%℃、沸点:-33.5%℃),联氨(N2H4熔点:2℃、沸点:113.5°C)解释其熔沸点高低的主要原因______________________。
(5)Co(NH3)5BrSO4可形成两种钴的配合物,已知Co3+的配位数为6,为确定钻的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,则第一种配合物的配体为___________。在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为___________。

(6)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如上图所示,则该物质的化学式为___________。若品体密度为dg·cm-3,则晶胞中最近的两个碳原子的距离为___________pm(阿伏加德罗常数的值用NA表示,写出简化后的计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 电解精炼铜时转移了NA个电子,阳极溶解了32g铜
B. 1mol FeCl3完全水解后可生成NA个氢氧化铁胶粒
C. 常温下,1mol氯气通入足量水中发生反应转移的电子数为NA
D. 100mL 0.1mol/L Na2CO3溶液中含有的阴离子数目大于0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. 漂白粉露置在空气中失效:2ClO-+CO2+H2O===2HClO+CO32-
B. 银氨溶液中滴加过量的盐酸:Ag(NH3)2++2H+===Ag++2NH4+
C. 二氧化锰与浓盐酸共热制取氯气:MnO2+2Cl-+4H+![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
D. 用碱性NaClO溶液吸收冶金工业尾气中的NO2:ClO-+2NO2+H2O===Cl-+2NO3-+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,NaCN溶液中CN-、HCN浓度所占分数(δ)随pH变化的关系如下图甲所示。向10 mL 0.01 mol·L-1 NaCN溶液中逐滴加入0.01 mol·L-1的盐酸,其pH变化曲线如下图乙所示。
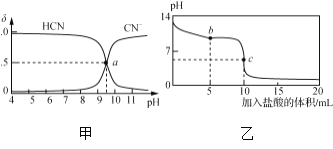
下列溶液中微粒的物质的量浓度关系一定正确的是( )
A. 图甲中pH=7的溶液:c(Cl-)=c(HCN)
B. 图甲中a点的溶液:c(CN-)<c(Cl-)
C. 图乙中b点的溶液:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+)
D. 图乙中c点的溶液:c(Na+)+c(H+)=c(HCN)+c(OH-)+2c(CN-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡(SnCl4)常用于染色的媒染剂等,工业上常用氯气与金属锡反应制备四氯化锡,某研究性学习小组在实验室用以下装置模拟四氯化锡的制备(夹持装置略)。

已知:①金属锡熔点为231℃,化学活泼性与铁相似。
②SnCl4为无色液体,熔点-33℃,沸点114℃,极易水解生成SnO2·xH2O,在潮湿的空气中发烟。
③SnCl2中的Sn2+易被氧化为Sn4+。
请回答下列问题:
(1)仪器F的名称是_______________,装置B中的试剂是_____________(填名称)。
(2)实验前应先点燃_________(填“A”或“E”)处的酒精灯,待__________(填实验现象)后,再点燃另外一处的酒精灯。
(3)若没有装置C(其他均相同),则D中发生的主要副反应的化学方程式为__________。
(4)该实验装置存在设计缺陷,你的改进措施为______________________________。
(5)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):取0.7500g锡粉溶于足量稀盐酸中,向生成的SnCl2溶液中加入过量的FeCl3溶液,用物质的量浓度为0.1000molL-1 K2Cr2O7标准溶液滴定生成的Fe2+(已知酸性环境下Cr2O72-可被还原为Cr3+),共用去K2Cr2O7溶液的体积为20.00mL。
①锡粒中锡的质量分数_____。
②若溶解锡粉的过程生成的SnCl2溶液中含有Sn![]() ,则测定结果将__________(填“偏高”、“偏低”或“无影响”)
,则测定结果将__________(填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,发生氧化反应的物质是_______,氧化剂是_____________,还原剂是_____________,氧化产物是_____________,还原产物是_____________。
MnCl2+Cl2↑+2H2O,发生氧化反应的物质是_______,氧化剂是_____________,还原剂是_____________,氧化产物是_____________,还原产物是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种钌(Ru)基配合物光敏染料敏化太阳能电池,其原理如图所示。下列说法错误的是

A. 电池工作时,光能转变为电能,X为电池的负极
B. 电池工作时,电解质溶液中I-和I3-的浓度基本不变
C. 镀铂导电玻璃上发生氧化反应生成I-
D. 电解质溶液中发生反应:2Ru3++3I![]() 2Ru2++I3-
2Ru2++I3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com