
| A. | 一CH3(甲基)的电子式为 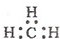 | B. | 硝基苯的结构简式: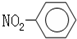 | ||
| C. | 甲醛的结构式: | D. | 乙醇的分子式:CH3CH2OH |
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:填空题
 用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(nm) | 0.186 | 0.160 | 0.037 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 | +1 | +2 | +1 | +3 | +5、-3 | +7、-1 | +5、-3 | -2 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢化物不稳定 | |
| B. | 最高价氧化物对应的水化物是一种强酸 | |
| C. | 其单质既有氧化性又有还原性 | |
| D. | 是植物生长所需要的一种营养元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
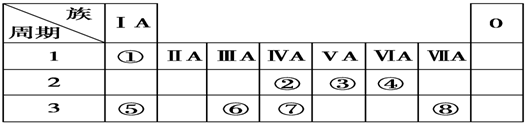
 .②的最高价氧化物的电子式是:
.②的最高价氧化物的电子式是:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机物都是天然产物 | |
| B. | 自然界中存在着多种形式的、大量的有机物 | |
| C. | 有机物除含碳元素外,还含有其他多种元素 | |
| D. | 碳原子能与其他原子形成四个共价键,且碳原子之间也能相互成键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com