
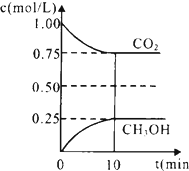
 二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放.
二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放.分析 (1)①平衡状态的标志可以两个方两去判断,一、是看正逆反应速是否相等,二是各组分的浓度和分数是否随时间的改变而改变;也可以抓住未平衡时是个变量,现在不变说明已经达到平衡状态了,来解决问题;
②根据外界条件的改变来判断平衡移动方向,然后去分析分子和分母的变化情况;
③用三行式来求平衡时的各组分浓度,然后代入平衡常数表达式求解,要注意代入平衡常数表达式是平衡浓度,平衡常数是温度的函数,温度变平衡常数才变,到底如何变,还要看反应的热效应;
解答 解:(1)①未平衡时是个变量,现在不变说明已经达到平衡状态了,
A.未平衡CO2的体积分数是个变化的量,现在混合气体CO2的体积分数保持不变,说明已经平衡了,故A正确;
B.未平衡时混合气体的平均相对分子质量是个变化的量,现在不随时间的变化而变化,说明已经达平衡状态,故B正确;
C.单位时间内每消耗1.2mol H2,向正方向,同时生成0.4mol H2O,也向正方向,不能反映正逆反应之间的关系,故C错误;
D.反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变,不能说明各自的量不再随时间的变化而变化,故C错误;
故选AB;
②A.升高温度,平衡逆向移动,故比值减小,故A不选;
B.恒温恒容下充入He(g),平衡不移动,故比值不变,故B不选;
C.将H2O(g)从体系中分离,平衡正向移动,故比值变大,故选C;
D.恒温恒容再充入2mol CO2和3mol H2,相当于增大压强,平衡正向移动,故比值变大,故选D;
故答案为CD;
③CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
初始(mol/L) 1 1.5 0 0
变化(mol/L) 0.25 0.75 0.25 0.25
平衡(mol/L) 0.75 0.75 0.25 0.25
所以 K=$\frac{0.25×0.25}{0.75×0.7{5}^{3}}$=0.20,
而平衡常数是温度的函数,只有通过改变温度来改变平衡常数,正反应量放热反应,降低温度,K值变大,故答案为:0.20;c.
点评 本题考查了化学平衡的有关知识,学生要学会三行式在解题中的应用,综合性强,但难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 .
.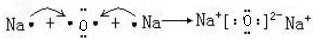 .
. .元素D在元素周期表中的位置是第三周期第VIIA族.
.元素D在元素周期表中的位置是第三周期第VIIA族.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
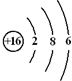 用电子式表示化合物 C2D 的形成过程
用电子式表示化合物 C2D 的形成过程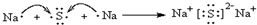
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 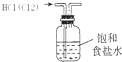 装置可除去HCl中的Cl2杂质 | |
| B. | 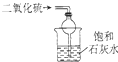 装置可吸收SO2,并防止倒吸 | |
| C. | 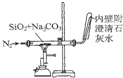 装置石灰水变浑浊即可证明非金属性:Si>C | |
| D. | 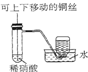 装置可制取并收集NO气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
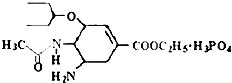 研究发现,奥司他韦可以有效治疗H1N1 流感,奥司他韦分子式为C16H28N2O4•H3PO4,分子结构如图.下列有关奥司他韦的说法中正确的是( )
研究发现,奥司他韦可以有效治疗H1N1 流感,奥司他韦分子式为C16H28N2O4•H3PO4,分子结构如图.下列有关奥司他韦的说法中正确的是( )| A. | 含极性键,易溶于水,其水溶液有丁达尔效应 | |
| B. | 分子中含有酯基、氨基、苯环等官能团 | |
| C. | 1mol 该物质最多能与3molNaOH反应 | |
| D. | 可以发生加成、取代、氧化反应、还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 含有离子键的化合物一定是离子化合物 | |
| B. | 同种非金属元素间不可能形成离子键 | |
| C. | 非金属元素间不可能形成离子化合物 | |
| D. | 分子中一定存在共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水玻璃可用作木材防火剂 | B. | 用大量的二氧化硫作食品漂白剂 | ||
| C. | 硅可用于制造太阳能电池 | D. | 食醋可作除去保温瓶的水垢 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com