
 Mg3N2��
Mg3N2�� N�������ɵ���þ��þԭ�����ʵ�����xmol����Ԫ�غ͵�Ԫ�ص����������b�����У�16-
N�������ɵ���þ��þԭ�����ʵ�����xmol����Ԫ�غ͵�Ԫ�ص����������b�����У�16- ��14��x=b�����x=
��14��x=b�����x=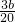 mol�����ɵĵ���þ�����ǣ�100��
mol�����ɵĵ���þ�����ǣ�100�� ��
��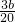 =5b��g��������þ�����������ǣ�
=5b��g��������þ�����������ǣ�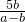 ��
��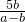 ��
��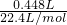 =0.02mol����ת�Ƶ��ӵ����ʵ���n��e-��=0.02mol��4=0.08mol
=0.02mol����ת�Ƶ��ӵ����ʵ���n��e-��=0.02mol��4=0.08mol ��0.1mol=0.05mol��V=22.4L/mol��0.05mol=1.12L��
��0.1mol=0.05mol��V=22.4L/mol��0.05mol=1.12L��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 5b |
| a-b |
| 5b |
| a-b |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ���Ϻ���������������ѧ�ڶ�ģ��ѧ�Ծ��������棩 ���ͣ�������
�������仯����仯�࣬��;�㡣��������м��㣺
��1�������ʵ�����þ�������г�����գ���������Ϊa g�������ڿ������������ò�������b g�����ڿ��������պ�IJ�����Mg3N2������������ ����a��b��ʾ��ֻ���ǿ����е������������뷴Ӧ����
��2��Ӳ����������Ҫ�ɷ֣��ڴ˽�����Al-Cu�Ͻ𣩳����ڽ���װ�ꡣ1.18gij��Ӳ��ǡ����10mLijŨ�ȵ�������ȫ��Ӧ�����ɵĻ�����壨����NO2��NO�������Ϊ2��1������448mL��������״������ϣ�ǡ���ܱ�ˮ��ȫ���ա�
�ټ������������ʵ���Ũ�ȡ�
�ڼ��㲢ȷ������Ӳ���Ļ�ѧʽ��
��3��ȡ5.1g Al-Mg�Ͻ���200mL 1mol��L-1��NaOH(aq)��ַ�Ӧ����������a L�����ˣ�����Һ��ͨ��V L CO2��ʼ���ֳ���������ͨ��CO2ʹ������ȫ�����ˡ�ϴ�ӡ�������գ��õ�����5.1 g����a = ��V = �������������Ϊ��״����
��4����Cu��Cu2O��CuO�Ļ�Ϸ�ĩ�м���500mL 0.6 mol��L-1 HNO3(aq)��ǡ����ȫ�ܽ⣬ͬʱ�ռ���1120 mL NO����״������ͨ�������ƶϻ�Ϸ�ĩ��Cu�����ʵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
±�ص��ʵ����ʻ��ã�±�صĻ�����Ӧ�ù㷺���о�±�ص��ʼ��仯���������Ҫ���塣
��1�������������ر�����ת���˲�Ҫ����ͬƷ�ƽ��ۼ����ʹ�õľ��档�ݱ�������ȫ�����ط����˶����Ͻ��ۼ����������ж����¼���������Ļ�ѧ֪ʶ���������жϣ�
������ʹ�õ�Һ̬���ۼ�֮һ�ض����ȣ�����ܵĴ�����ʽ�������� �������� ������һ�־������������� �����ʣ���Һ̬���ۼ���֮��ϣ����ܷ������·�Ӧ������������������������������������
��
(2)�������ε������Խ�ǿ�����ڼ��Ի����н�����������������������佫Fe3+����Ϊ����ɱ��������FeO42-��д���÷�Ӧ�����ӷ���ʽ ��
(3)���ٵƾ��бȰ׳���������һ������ܵ��ص㡣һ���¶��£������ڷ�����������ʹ�ù����г����ڹܱ��ϵ��ٿ��Է�����Ӧ��
W(s)+I2(g)![]() WI2(g)��Ϊģ��������Ӧ��ȷ��ȡ0.508g�⡢0.736g����������50.0mL���ܱ������У� ����ʹ�䷴Ӧ��
WI2(g)��Ϊģ��������Ӧ��ȷ��ȡ0.508g�⡢0.736g����������50.0mL���ܱ������У� ����ʹ�䷴Ӧ��
��ͼ��WI2(g)�����ʵ�����ʱ��仯��ϵͼ����������I(0~t2ʱ���)�ķ�Ӧ�¶�ΪT1������II(��t2��ʼ)�ķ�Ӧ�¶�ΪT2����T2>T1��ks*5*u
|
|
|
|

�ٸ÷�Ӧ�ġ�H 0(�>�� ��=����<��)
�ڴӷ�Ӧ��ʼ��t1ʱ���ڵ�ƽ����Ӧ����v(I2)= ��
������˵���в���ȷ���� (�����)��
A���÷�Ӧ��ƽ�ⳣ������ʽ��![]()
B����˿�����¶�Խ�ߣ���˿��������WI2Խ�ױ�ΪW�����³�������˿��
C�����ø÷�Ӧԭ�������ᴿ��
(4)25��ʱ����5mL����KCl��KIŨ�Ⱦ�Ϊ0.1mol/L�Ļ��Һ�У��μ�6mL0.1mol/L��AgNO3��Һ����Һ������Ũ���ɴ�С��˳���� ��
[������H+��OH-��25��ʱKSP(AgCl)=1.8��10-10��KSP(AgI)=8.3��10-17]��
(5)Mg�������ᴿTi���Լ�����֪��
��Mg(s)+Cl2(g)=MgCl2(s) ��H= ��641kJ/mol ��Ti(s)+2Cl2(g)=TiCl4(l) ��H= ��770kJ/mol
��д��Mg��Һ̬TiCl4��Ӧ�ᴿ�ѵ��Ȼ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
±�ص��ʵ����ʻ��ã�±�صĻ�����Ӧ�ù㷺���о�±�ص��ʼ��仯���������Ҫ���塣
��1�������������ر�����ת���˲�Ҫ����ͬƷ�ƽ��ۼ����ʹ�õľ��档�ݱ�������ȫ�����ط����˶����Ͻ��ۼ����������ж����¼���������Ļ�ѧ֪ʶ���������жϣ�
������ʹ�õ�Һ̬���ۼ�֮һ�ض����ȣ�����ܵĴ�����ʽ�������� �������� ������һ�־������������� �����ʣ���Һ̬���ۼ���֮��ϣ����ܷ������·�Ӧ������������������������������������
��
(2)�������ε������Խ�ǿ�����ڼ��Ի����н�����������������������佫Fe3+����Ϊ����ɱ��������FeO42-��д���÷�Ӧ�����ӷ���ʽ ��
(3)���ٵƾ��бȰ׳���������һ������ܵ��ص㡣һ���¶��£������ڷ�����������ʹ�ù����г����ڹܱ��ϵ��ٿ��Է�����Ӧ��
W(s)+I2(g)![]() WI2(g)��Ϊģ��������Ӧ��ȷ��ȡ0.508g�⡢0.736g����������50.0mL���ܱ������У� ����ʹ�䷴Ӧ��
WI2(g)��Ϊģ��������Ӧ��ȷ��ȡ0.508g�⡢0.736g����������50.0mL���ܱ������У� ����ʹ�䷴Ӧ��
��ͼ��WI2(g)�����ʵ�����ʱ��仯��ϵͼ����������I(0~t2ʱ���)�ķ�Ӧ�¶�ΪT1������II(��t2��ʼ)�ķ�Ӧ�¶�ΪT2����T2>T1��
|
|
|
|
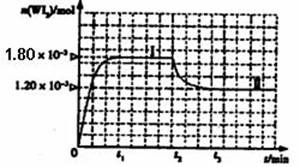
�ٸ÷�Ӧ�ġ�H 0(�>�� ��=����<��)
�ڴӷ�Ӧ��ʼ��t1ʱ���ڵ�ƽ����Ӧ����v(I2)= ��
������˵���в���ȷ���� (�����)��
A���÷�Ӧ��ƽ�ⳣ������ʽ��![]()
B����˿�����¶�Խ�ߣ���˿��������WI2Խ�ױ�ΪW�����³�������˿��
C�����ø÷�Ӧԭ�������ᴿ��
(4)25��ʱ����5mL����KCl��KIŨ�Ⱦ�Ϊ0.1mol/L�Ļ��Һ�У��μ�6mL0.1mol/L��AgNO3��Һ����Һ������Ũ���ɴ�С��˳���� ��
[������H+��OH-��25��ʱKSP(AgCl)=1.8��10-10��KSP(AgI)=8.3��10-17]��
(5)Mg�������ᴿTi���Լ�����֪��
��Mg(s)+Cl2(g)=MgCl2(s) ��H= ��641kJ/mol ��Ti(s)+2Cl2(g)=TiCl4(l) ��H= ��770kJ/mol
��д��Mg��Һ̬TiCl4��Ӧ�ᴿ�ѵ��Ȼ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com