
【题目】赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热发生以下反应:Cu2S+2Cu2O![]() 6Cu+SO2↑,关于该反应的说法中正确的是
6Cu+SO2↑,关于该反应的说法中正确的是
A. 该反应的氧化剂只有Cu2O
B. Cu2S在反应中既是氧化剂,又是还原剂
C. Cu既是氧化产物又是还原产物
D. 每生成19.2gCu,反应中转移0.6 mole![]()
科目:高中化学 来源: 题型:
【题目】氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。

(1)过滤所需要的主要玻璃仪器有________________________________。
(2)加入BaCl2的目的是_______________,加MgO后过滤所得滤渣的主要成分为___。
(3)加入NaClO3饱和溶液后发生反应的化学方程式为__________________________,
再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:
①蒸发结晶;②___________;洗涤;③将滤液冷却结晶;④过滤、洗涤。
(4)产品中Mg(ClO3)2·6H2O含量的测定(已知Mg(ClO3)2·6H2O的摩尔质量为299g/mol )。
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00mL于锥形瓶中,加入10.00mL稀硫酸和20.00mL1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol/L K2Cr2O7溶液滴定剩余的Fe2+至终点。反应的方程式为:
______Cr2O72-+___Fe2++___ H+= ___Cr3++___Fe3++____H2O (请配平)。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00 mL。
写出步骤2中发生反应的离子方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向质量分数为2a%,体积为10 mL,物质的量浓度为c1mol·L-1的稀H2SO4中加入V mL 的水,使之质量分数变为 a%,此时物质的量浓度为c2mol·L-1,则下列关系正确的是
A. V>10, 2c2=c1 B. V<10,2c2﹤c1
C. V>10,2c2<c1 D. V>10, 2c2>c1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾是对大气中各种悬浮颗粒物含量超标的笼统表述,但雾和霾的区别很大。雾是由大量悬浮在近地面空气中的微小水滴或冰晶组成的气溶胶系统,属于自然现象。霾是空气中的灰尘、硫酸、硝酸等颗粒物组成的气溶胶系统造成视觉障碍,属于大气污染。如图为霾的主要成分示意图。下列说法不正确的是
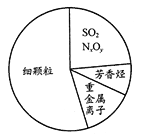
A. 汽车尾气的大量排放是造成雾霾天气的人为因素之一
B. 雾天开车时,汽车车灯的光束在雾中能产生丁达尔效应
C. 苯、甲苯、二甲苯都属于芳香烃
D. SO2和NxOy都属于酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是()。

A. 汉黄芩素的分子式为C16H13O5
B. 该物质遇FeCl3溶液显色
C. 1 mol该物质与溴水反应,最多消耗1 mol Br2
D. 与足量H2发生加成反应后,该分子中官能团的种类减少1种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种安全无毒的物质,带有结晶水,通常还含有CaO。经审查,面粉中添加过氧化钙已无技术上的必要性,因此,卫生部严令禁止在面粉生产中添加等添加剂。但过氧化钙在工农业生产中广泛用作杀菌剂、防腐剂、解酸剂、油类漂白剂等。
(1)称取5.42 g过氧化钙样品,灼热时发生如下反应:
2[CaO2·xH2O] → 2CaO + O2↑+ 2xH2O,得到O2在标准状况下体积为672 mL,该样品中CaO2的物质的量为________。
(2)另取同一样品5.42 g,溶于适量稀盐酸中,然后加入足量的Na2CO3溶液,将溶液中Ca2+全部转化为CaCO3沉淀,得到干燥的CaCO3 7.0 g。
①样品中CaO的质量为________。
②样品中CaO2·xH2O中的x值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钙常用于道路融冰剂和干燥剂,具有易溶于水,易吸潮等性质。实验室用工业大理石(含有少量Al2O3、Fe2O3等杂质)制备氯化钙的主要流程如下:
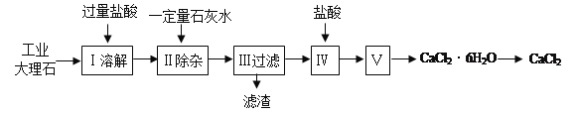 完成下列填空:
完成下列填空:
(1)上述使用的盐酸的物质的量浓度约为6.0mol/L,若用36.5%的盐酸(密度为1.2g/mL)配置6.0mol/L的盐酸100mL,所需的玻璃仪器有玻璃棒、量筒、胶头滴管、 ;需要量取36.5%的盐酸 mL;配制过程中,若其他操作都正确,下列操作会引起浓度偏小的是 。
A.定容摇匀后发现液面低于刻度线 |
B.定容时俯视容量瓶的刻度线 |
C.将溶液转入容量瓶后,没有洗涤烧杯和玻璃棒,就转入定容操作 |
D.如果加水超过了刻度线,取出少量水使液面恰好到刻度线 |
(2)步骤Ⅰ中有关反应的离子方程式有: 、 、 。
(3)步骤Ⅱ控制石灰水用量的目的是防止(用离子方程式表示): 。
(4)滤渣的主要成分有(写化学式) 。
(5)步骤Ⅴ所含的操作依次是 、 。
(6)制得的氯化钙可以通过如下步骤测定其纯度:
①称取5.5g无水氯化钙样品;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤;④ 、 ;⑤称量。若得到4.3g碳酸钙,则氯化钙的质量分数为 ;若实验操作规范而测定结果偏低,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应知识贯穿于中学化学教材,从初中阶段的简单了解,到高中基本理论知识,再到元素化合物部分的实际应用,再到化学电源本质的理解,再到有机化学中物质类型的变化关系,层层推进,高潮迭起。分析氧化还原反应常用双线桥法和单线桥法来表示电子转移的方向和数目。
I.在KClO3+6HCl=KCl+3Cl2↑+3H2O的反应中:
(1)请用单线桥法标出电子转移的方向和数目________;
(2)该反应中,氧化产物与还原产物的物质的量之比为_____________;
(3)若生成 0.3 mol Cl2,则转移的电子的数目为________________;
II.已知硫化亚铁是一种黑色块状固体,在空气中煅烧时生成二氧化硫气体和烧渣;硫化亚铁常温下难溶于水,易溶于稀盐酸、稀硫酸而生成能溶于水的硫化氢气体。硫化亚铁与浓硫酸加热条件下,可发生反应:2FeS+6H2SO4(浓) ![]() Fe2(SO4)3+3SO2↑ +2S+6H2O:
Fe2(SO4)3+3SO2↑ +2S+6H2O:
(4)请用双线桥法标出电子转移的方向和数目_______。
(5)H2SO4在该反应中显示出来的性质是___________;(填序号)
A.氧化性 B.还原性 C.酸性 D.碱性
(6)该反应中,氧化产物是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁[(C5H5)2Fe]的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。已知二茂铁熔点是173 ℃(在100 ℃时开始升华),沸点是249 ℃,不溶于水,易溶于苯、乙醚等非极性溶剂。下列说法不正确的是( )
A. 二茂铁属于分子晶体
B. 在二茂铁结构中,C5H![]() 与Fe2+之间形成的化学键类型是离子键
与Fe2+之间形成的化学键类型是离子键
C. 已知:环戊二烯的结构式为: ,则其中仅有1个碳原子采取sp3杂化
,则其中仅有1个碳原子采取sp3杂化
D. C5H![]() 中一定含π键
中一定含π键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com