
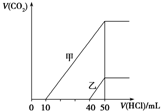
| A. | 原NaOH溶液的物质的量浓度为0.5 mol•L-1 | |
| B. | 当0<V(HCl)<10 mL时,甲溶液中发生反应的离子方程式为:OH-+H+═H2O | |
| C. | 乙溶液中含有的溶质是NaOH、NaHCO3 | |
| D. | 乙溶液中滴加盐酸后产生CO2体积的最大值为112 mL(标准状况) |
分析 在氢氧化钠溶液中通入一定量的二氧化碳后,溶液中溶质的组成可能是NaOH和Na2CO3、Na2CO3、Na2CO3和NaHCO3、NaHCO3四种情况,没有产生二氧化碳时的反应可能为:OH-+H+=H2O和CO32-+H+=HCO3-,产生二氧化碳的反应为:HCO3-+H+=H2O+CO2↑;
根据加入50mL盐酸时溶质为氯化钠及原子守恒计算出氢氧化钠的物质的量浓度;
根据图象可知,甲溶液中溶质只能为Na2CO3和NaHCO3,乙溶液的溶质为NaOH和Na2CO3;
根据HCO3-+H+=H2O+CO2↑计算出乙溶液中产生二氧化碳的最大值.
解答 解:A.根据图象可知,当V(HCl)=50mL时,得到的产物为NaCl,由原子守恒可知:n(NaOH)=n(NaCl)=n(HCl)=0.1mol/L×0.05L=0.005mol,则原氢氧化钠溶液的浓度为:c(NaOH)=$\frac{0.005mol}{0.01L}$=0.5mol/L,故A正确;
B.在氢氧化钠溶液中通入一定量的二氧化碳后,溶液中溶质的组成可能是:NaOH和Na2CO3、Na2CO3、Na2CO3和NaHCO3、NaHCO3四种情况,由图中HCl 的用量与产生二氧化碳气体体积的关系可知甲溶液的溶质应该为:Na2CO3和NaHCO3,所以当0<V(HCl)<10mL时,甲溶液中没有产生二氧化碳的离子方程式为:CO32-+H+=HCO3-,故B错误;
C.氢氧化钠溶液中通入二氧化碳,溶质不可能为NaOH、NaHCO3,根据图象可知,乙溶液中的溶质为NaOH和Na2CO3,故C错误;
D.乙溶液中滴加盐酸,产生二氧化碳的阶段为:HCO3-+H+=H2O+CO2↑,根据消耗了10mL盐酸可知,生成二氧化碳的物质的量为:0.1mol/L×0.01L=0.001mol,标况下0.001mol二氧化碳的物质的量为:22.4L/mol×0.001mol=22.4mL,故D错误;
故选A.
点评 本题考查混合物的有关计算,为高频考点,把握图中曲线及发生的反应的关系计算出NaOH、CO2的物质的量为解答的关键,注意判断CO2与NaOH反应产物,题目难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 铝与氢氧化钠溶液反应生成67.2LH2时,转移的电子数为9NA | |
| B. | 2L0.5mol/L醋酸钠溶液中含CH3COO-个数小于NA | |
| C. | 28gCO和C2H4的混合气体中含有的碳原子总数为1.5NA | |
| D. | 2molSO2与2molO2在密闭容器中充分反应后,容器内的气体分子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水溶液中:K+、Ca2+、C1-、NO${\;}_{3}^{-}$ | |
| B. | 空气:CH4、CO2、SO2、NO | |
| C. | 氢氧化铁胶体:H+、K+、S2-、Br- | |
| D. | 高锰酸钾溶液:H+、Na+、SO${\;}_{4}^{2-}$、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuH与稀盐酸反应的化学方程式为2CuH+2HCl═CuCl2+2H2↑+Cu | |
| B. | CuH在足量氯气中燃烧的化学方程式为2CuH+Cl2═2Cu+2HCl | |
| C. | CuH在稀硝酸反应的化学方程式为CuH+3HNO3═Cu(NO3)2+NO↑+2H2O | |
| D. | CuH受热分解的化学方程式为2CuH═2Cu+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
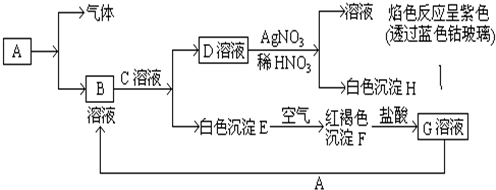
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
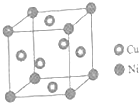 东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题:
东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com