
【题目】(1)t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应: 2SO2(g)+O2(g)═2SO3(g),此反应放热。2min时反应达到化学平衡,此时测得容器内的压强为起始压强的0.8倍,请填写下列空白:
①从反应开始到达化学平衡,生成SO3的平均反应速率为_______;平衡时,SO2 转化率为 _____
②下列叙述能证明该反应已达到化学平衡状态的是 _________
A.容器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2nmolSO2的同时消耗nmolO2
E.相同时间内消耗2nmolSO2 的同时生成nmolO2
F.混合气体密度不再变化
(2)Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2═4LiCl+S+SO2。请回答下列问题:
①电池的负极材料为______,发生的电极反应为______;
②电池正极发生的电极反应为______;
③SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,实验现象是____,反应的化学方程式为______
(3)一种以肼(N2H4)为液体燃料的电池装置如图所示。该电池用空气中的氧气作氧化剂,KOH作电解质。负极反应式为 ______ ,正极反应式为 ____
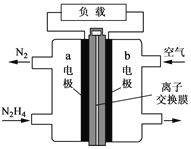
【答案】0.3mol/(Lmin) 60% ABE 锂 Li-e-═Li+ 2SOCl2+4e-=4Cl-+S+SO2 出现白雾,有刺激性气体生成 SOCl2+H2O=SO2↑+2HCl↑ N2H4+4OH--4e-=N2↑+4H2O O2+4e-+2H2O=4OH-
【解析】
(1)①利用“三段式”,根据恒温恒容条件下,压强比等于物质的量比计算达到平衡时SO2浓度的变化量。
②根据平衡标志判断;
(2)①根据电池总反应,4Li+2SOCl2═4LiCl+S+SO2,可知Li失电子发生氧化反应;
②正极反应式可由总反应减去负极反应式得到;
③把少量水滴到SOCl2中,发生水解反应生成二氧化硫和氯化氢;
(3)b极通入空气,则氧气发生还原反应,作原电池的正极,N2H4在a极发生氧化反应,生成氮气和水;
(1)①
2SO2(g)+O2(g)═2SO3(g)
开始 1 0.5 0
转化 2x x 2x
平衡 1-2x 0.5-x 2x
恒温恒容条件下,压强比等于物质的量比,则![]() ,x=0.3。从反应开始到达化学平衡,生成SO3的平均反应速率为
,x=0.3。从反应开始到达化学平衡,生成SO3的平均反应速率为![]() 0.3mol/(Lmin);平衡时,SO2 转化率为
0.3mol/(Lmin);平衡时,SO2 转化率为![]() 60%;
60%;
②A.反应前后气体物质的量改变,恒温恒容条件下,压强是变量,容器内压强不再发生变化时,一定达到平衡状态,故选A;
B.根据化学平衡的定义,SO2的体积分数不再发生变化,一定达到平衡状态,故选B;
C.化学变化中,原子数是恒量,容器内气体原子总数不再发生变化,不一定平衡,故不选C;
D.相同时间内消耗2nmolSO2的同时消耗nmolO2 ,都是指正反应速率,不一定平衡,故不选D;
E.相同时间内消耗2nmolSO2 的同时生成nmolO2 ,正逆反应速率比等于系数比,一定达到平衡状态,故选E;
F.反应前后气体质量不变,恒温恒容条件下,密度是恒量,混合气体密度不再变化,不一定平衡,故不选F。
(2)①根据电池总反应,4Li+2SOCl2═4LiCl+S+SO2,可知Li失电子发生氧化反应,Li是负极,负极反应式是Li-e-═Li+;
②总反应减去负极反应式得正极反应式2SOCl2+4e-=4Cl-+S+SO2;
③把少量水滴到SOCl2中,发生水解反应生成二氧化硫和氯化氢,现象是出现白雾,有刺激性气体生成,反应方程式是SOCl2+H2O=SO2↑+2HCl↑;
(3)b极通入空气,则氧气发生还原反应生成氢氧根离子,作原电池的正极,正极反应式为O2+4e-+2H2O=4OH-,N2H4在a极发生氧化反应,生成氮气和水;a为负极,负极反应式为N2H4+4OH--4e-=N2↑+4H2O。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中发生如下反应:A(s)+2B(g)![]() 2C(g) ΔH<0,反应过程中B、C的物质的量随时间变化的关系如图1;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如图2.下列有关说法正确的是
2C(g) ΔH<0,反应过程中B、C的物质的量随时间变化的关系如图1;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如图2.下列有关说法正确的是
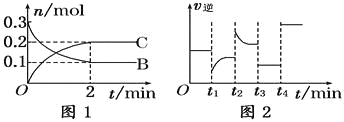
A. 反应开始2 min内,v(B)=0.1 mol/(L·min)
B. t1时改变的条件可能是升高温度
C. t3时改变的条件可能是加压,此时c(B)不变
D. t4时可能是使用了催化剂,此时c(B)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研制出的八硝基立方烷(结构如图所示,碳原子未画出)是一种新型高能炸药,爆炸分解得到无毒、稳定的气体,下列说法正确的是 ( )
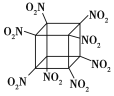
A. 分子中C、N间形成非极性键B. 1 mol该分子中含8 mol二氧化氮
C. 该物质既有氧化性又有还原性D. 该物质爆炸产物是NO2、CO2、H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某校化学研究性学习小组探究的过量的Fe与浓硫酸反应的实验:
I.甲同学设计如下实验反应得到的混合气体中含有SO2、H2、H2O
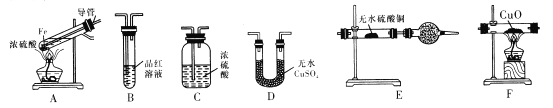
己知:CaSO3受热易分解
(1)写出过量Fe粉与浓硫酸反应产生等体积的SO2与H2的总化学方程式:________。
(2)若按气体从左到右的流向,为达到实验目的,各装置连接顺序是A→______(不可重复使用)。
(3)A中导管的作用为______,装置E中的干燥管中盛放的物质为碱石灰,其作用是________。
(4)证明有H2存在的实验现象是_________。
II.为测定混合气体中SO2的体积分数,,乙同学设计了如下实验方案:

(5) W溶液可以是下列溶液中的______(填字母代号);
A.H2O2溶液 B.NaOH溶液 C.KMnO4溶液(硫酸酸化) D.氯水
该混合气体中二氧化硫的体积分数为_______(用含V、m的代数式表示)。
(6)丙同学使用cmol/LxmLI2的淀粉溶液(过量)吸收混合气体,充分反应后,用0.1000mol/L的Na2S2O3标准溶液去滴定I2的淀粉溶液,达到滴定终点时消耗Na2S2O3的体积为20mL,该混合气体中二氧化硫的体积分数为______(用含V、c、x的代数式表示)[已知:I2+2S2O32-=2I-+S4O62-]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的认识不正确的是
A. 油脂在空气中完全燃烧转化为水和二氧化碳
B. 蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体
C. 在水溶液里,乙酸分子中的—CH3可以电离出H+
D. 在浓硫酸存在下,苯与浓硫酸共热生成硝基苯的反应属于取代反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖是人类的营养素,在体内富氧条件下被氧化生成二氧化碳和水,在缺氧条件下则生成一种有机酸A。已知:
①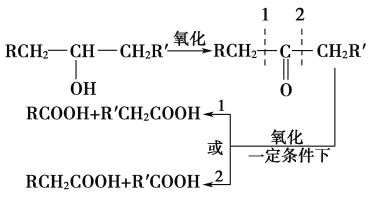
②将A进行如图所示的反应,其中C和C′是同系物,C′是甲酸(HCOOH)。
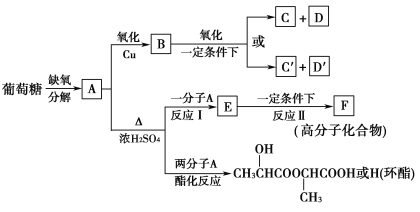
回答下列问题:
(1)C和D′属于________(填序号)。
①同系物 ②同分异构体 ③同类物质 ④同素异形体
(2)D′和E分别属于哪一类化合物:D′____________,E____________(填序号)。
①多元醇 ②醛 ③不饱和羧酸 ④多元羧酸 ⑤酯
(3)写出结构简式:A________,F________,H________。
(4)写出反应类型:反应Ⅰ:____________________,反应Ⅱ:____________________。
(5)写出下列转化的化学方程式:
A→B__________________________________________________________;
A→E__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应的实验,不能达到实验目的的是
A | B | C | D | |
装置 |
|
|
|
|
实验 | 结合秒表定量比较锌与不同浓度的稀硫酸反应的快慢 | 证明温度对化学平衡的影响 | 验证铁钉发生吸氧腐蚀 | 可证明非金属性Cl>C>Si |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以苯为基本原料可制备X、Y、Z、W等物质,下列有关说法中正确的是( )

A. 反应①是苯与溴水的取代反应 B. 可用AgN03溶液检测W中是否混有Z
C. X、苯、Y分子中六个碳原子均共平面 D. 反应④中产物除W外还有H2O和NaCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com