
分析 混合气体对H2的相对密度是13.2,即混合气体平均相对分子质量为26.4,一定有甲烷,反应前充入气体为5,反应增加4%,为5.2,气体物质的量增加0.2mol,根据烃的燃烧反应方程式以及气体体积(物质的量)差量法计算即可.
解答 解:混合气体平均摩尔质量为13.2×M(H2)=26.4g/mol,两种气态物质相对分子质量一个大于26.4,一个小于26.4,所以一定有甲烷.对于甲烷而言,燃烧后(高于水的沸点)气体体积不变,充分燃烧说明产物只有二氧化碳和水,反应前充入气体为5,反应增加4%,为5.2,气体物质的量增加0.2mol,设烯烃中碳原子数为n、在1mol混合气(混合气体1体积)中物质的量为xmol,甲烷为(1-x)mol,
CnH2n+1.5nO2=nCO2+nH2O△n
1 1.5n n n (2n-1-1.5n)=0.5n-1
x 0.2
x=$\frac{0.2}{0.5n-1}$,所以 n(甲烷)=1-x=$\frac{5n-12}{5n-10}$,又1mol混合气质量为24g,所以16×$\frac{5n-12}{5n-10}$+$\frac{0.2}{0.5n-1}$×14n=24,解得n=4,烯烃为丁烯,丁烯物质的量x=$\frac{0.2}{0.5n-1}$=0.2mol,所以百分含量$\frac{0.2}{1}$×100%=20%,甲烷80%.体积之比是1:4,
答:混合气体的成分是甲烷和丁烯,其体积之比是:1:4.
点评 本题是有机混合物成分以及含量的推断计算题,注意平均相对分子质量个应用以及气体体积(物质的量)差量法在计算中的应用,难度中等.


科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
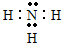 ,
,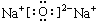 (或
(或 ).
).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
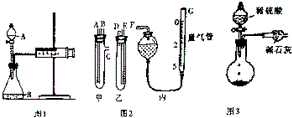 某校化学小组的同学开展测定Na2CO3和NaCl的固体混合物中Na2CO3质量分数的探究实验,他们提出下列实验方案-气体分析法.
某校化学小组的同学开展测定Na2CO3和NaCl的固体混合物中Na2CO3质量分数的探究实验,他们提出下列实验方案-气体分析法.| 样品号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 盐酸溶液的体积/mL | 30 | 30 | 30 | 30 |
| 样品质量/g | 3.32 | 4.15 | 5.81 | 7.47 |
| 二氧化碳的体积/mL | 672 | 840 | 896 | 672 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | Ca2+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol.L-1 | 2×10-6 | 6×10-6 | 2×10-5 | 4×10-6 | 3×10-5 | 2×10-6 |
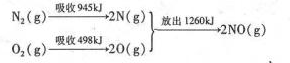
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 35.5g | B. | 71g | C. | 119g | D. | 142g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 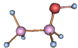 与 与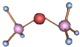 | B. | 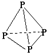 和 和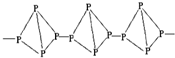 | ||
| C. | ${\;}_{1}^{1}$H2和${\;}_{1}^{2}$H2 | D. | H2O与H2O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com