


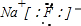 .
. 分析 由元素在周期表中的位置可知A为O元素,B为F元素,C为Na元素,D为Si元素,E为P元素,F为S元素,G为Cl元素,
(1)G为Cl,原子核外有3个电子层,最外层电子数为7;
(2)一般来说,原子核外电子层数越多,原子半径越大,同周期元素从左到右原子半径逐渐减小;
(3)非金属性P<S<Cl,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越大;
(4)非金属性F>O>Cl,元素的非金属性越强,对应的氢化物越稳定;
(5)C和B形成化合物为NaF,为离子化合物.
解答 解:由元素在周期表中的位置可知A为O元素,B为F元素,C为Na元素,D为Si元素,E为P元素,F为S元素,G为Cl元素,
(1)G为Cl,原子核外有3个电子层,最外层电子数为7,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)一般来说,原子核外电子层数越多,原子半径越大,同周期元素从左到右原子半径逐渐减小,则A、B、E、F五种元素的原子半径最大为E,即P,故答案为:P;
(3)非金属性P<S<Cl,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越大,则酸性最强的为HCl04,故答案为:HCl04;
(4)非金属性F>O>Cl,元素的非金属性越强,对应的氢化物越稳定,HF的稳定性最强,故答案为:HF;
(5)C和B形成化合物为NaF,为离子化合物,电子式为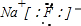 ,故答案为:
,故答案为: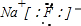 .
.
点评 本题考查元素周期表与元素周期律的综合应用,为高考常见题型和高频考点,比较基础,注意整体把握元素周期表结构,注意基础知识的积累掌握.


科目:高中化学 来源: 题型:多选题
| A. | 漂白粉的主要成分为次氯酸钙 | |
| B. | 实验室可用浓硫酸干燥氨气 | |
| C. | 实验室可用NaOH溶液处理NO2和HCl废气 | |
| D. | 从海水可获得在常温下为液体的单质是Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
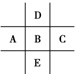 图为周期表的一部分,已知A、B、C、D、E五种元素原子核外共有85个电子,E位于周期表中第四周期,则B元素是( )
图为周期表的一部分,已知A、B、C、D、E五种元素原子核外共有85个电子,E位于周期表中第四周期,则B元素是( )| A. | P | B. | S | C. | Cl | D. | Si |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水分子的结构式是H-Cl-O | |
| B. | NaCl的电子式为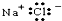 | |
| C. | 23Na37Cl中质子数和中子数之比是7:8 | |
| D. | 三氟化氮的电子式为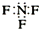 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4和C3H6的混合物的质量为ag,所含碳氢键数目为aNA/7 | |
| B. | 标准状况下,2.24L 2H35Cl中所含中子数为1.8NA | |
| C. | 50mL 12mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| D. | 1L 0.1mol•L-1的NaHCO3溶液中$HC{{O}_{3}}^{-}$和$C{{O}_{3}}^{2-}$的离子数之和为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com