


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
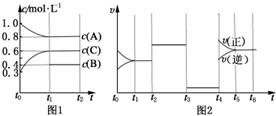 向体积为2L的密闭容器中充入2mol A、0.6mol C和一定量的B三种气体,一定条件下发生反应2A(g)+B(g)?3C(g)△H>0,各物质的浓度随时间变化的关系如图1所示,其中t0~t1阶段c(B)未画出.图2为反应体系中反应速率随时间变化的情况,且t2,t3,t4各改变一种不同的条件.
向体积为2L的密闭容器中充入2mol A、0.6mol C和一定量的B三种气体,一定条件下发生反应2A(g)+B(g)?3C(g)△H>0,各物质的浓度随时间变化的关系如图1所示,其中t0~t1阶段c(B)未画出.图2为反应体系中反应速率随时间变化的情况,且t2,t3,t4各改变一种不同的条件.查看答案和解析>>
科目:高中化学 来源: 题型:
 由周期表中前20号元素组成的单质X2、Y和化合物Z的有关信息如下表,X2、Y 和Z之间的转化关系如图(其他无关物质已略去).请回答下列问题:
由周期表中前20号元素组成的单质X2、Y和化合物Z的有关信息如下表,X2、Y 和Z之间的转化关系如图(其他无关物质已略去).请回答下列问题:| 元素X | 易形成-1价18电子的单核离子 |
| 元素Y | 第3周期第ⅥA族 |
| 化合物Z | 所含阳离子有3个电子层 |
| 常温下0.1mol?L-1的水溶液pH=13 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 HR是含Z元素的一元酸.室温时,用0.250mol?L-1 NaOH溶液滴定25.0mL HR溶液时,溶液的pH变化情况如图所示.其中,a点表示两种物质恰好完全反应.
HR是含Z元素的一元酸.室温时,用0.250mol?L-1 NaOH溶液滴定25.0mL HR溶液时,溶液的pH变化情况如图所示.其中,a点表示两种物质恰好完全反应.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| A、CO2(g)和CaO(s)的总能量大于CaCO3(s)的总能量 |
| B、该反应的焓变大于零 |
| C、该反应中有离子键断裂也有共价键断裂,化学键断裂吸收能量,化学键生成放出能量 |
| D、由该反应可推出凡是需要加热才发生的反应均为吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com