

 ;
; ;
;
| ||
| △ |
| ||
| △ |
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
| 1mol |
| x |
| 54g |
| 10.8g |
. |
| M |
| m |
| n |
| 16.8g |
| 0.4mol |
 ,
,| 2 |
| 16 |


科目:高中化学 来源: 题型:
| 碱 | 酸 | 盐 | 酸性氧化物 | |
| A | 纯碱 | 盐酸 | 烧碱 | 二氧化硫 |
| B | 烧碱 | 硫酸 | 食盐 | 一氧化碳 |
| C | 生石灰 | 醋酸 | 石灰水 | 水 |
| D | 苛性钠 | 碳酸 | 小苏打 | 三氧化硫 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 在100℃时,将0.40mol的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
在100℃时,将0.40mol的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知原子序数依次增大的A、B、C、D、E五种元素中有2种为非金属元素,其原子序数均小于30.其中A、B、C、E的价电子层中均有2个未成对电子,A、B同族且可以形成原子个数比为1:1的化合物BA,属于原子晶体.回答下列问题:
已知原子序数依次增大的A、B、C、D、E五种元素中有2种为非金属元素,其原子序数均小于30.其中A、B、C、E的价电子层中均有2个未成对电子,A、B同族且可以形成原子个数比为1:1的化合物BA,属于原子晶体.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 和
和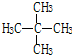
查看答案和解析>>
科目:高中化学 来源: 题型:
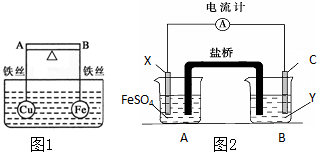 (1)如图1所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中央滴入浓硫酸铜溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)当杠杆为绝缘体时,A端比B端
(1)如图1所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中央滴入浓硫酸铜溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)当杠杆为绝缘体时,A端比B端查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)>c(HSO3-)>c(H+)>c(OH-) |
| B、c(Na+)=c(HSO3-)+2c(SO32-)+c(H2SO3) |
| C、c(OH-)+c(SO32-)=c(H2SO3)+c(H+) |
| D、c(Na+)+c(H+)=c(HSO3-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2+、K+、ClO-、Cl- |
| B、Ag+、Na+、Cl-、NO3- |
| C、NH4+、K+、CO32-、Br- |
| D、H+、Ca2+、CH3COO-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com