
化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
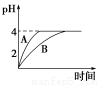
(1)常温下,取pH=2的盐酸和醋酸溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是________(填“A”或“B”)。设盐酸中参加反应的Zn粒质量为m1,醋酸溶液中参加反应的Zn粒质量为m2,则m1________m2(选填“<”、“=”或“>”)。
(2)已知常温下Cu(OH)2的Ksp=2×10-20。又知常温下某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于________;要使0.2 mol·L-1的CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加NaOH溶液,使溶液pH为________。
(3)10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度/℃ | 10 | 20 | 30 | 加热煮沸后冷却到50 ℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
在分析该溶液pH增大的原因时,甲同学认为是升高温度HCO3-的水解程度增大所致;乙同学认为是溶液中升高温度NaHCO3受热分解生成Na2CO3,CO32-水解程度大于HCO3-所致。请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)________________________________________________________________________。
(1)B < (2)5 6 (3)向溶液中加入足量BaCl2(或CaCl2)溶液,如果无白色沉淀生成说明甲正确,有白色沉淀产生说明乙正确
【解析】(1)醋酸溶液中存在CH3COOH CH3COO-+H+平衡,随着反应的进行,平衡右移,所以醋酸溶液中c(H+)变化速率慢,所以B表示醋酸;pH由2升高到4时,醋酸提供的H+的物质的量多,消耗的Zn多;(2)依Ksp=c(Cu2+)·c2(OH-)可知c2(OH-)=
CH3COO-+H+平衡,随着反应的进行,平衡右移,所以醋酸溶液中c(H+)变化速率慢,所以B表示醋酸;pH由2升高到4时,醋酸提供的H+的物质的量多,消耗的Zn多;(2)依Ksp=c(Cu2+)·c2(OH-)可知c2(OH-)= ,c(OH-)=10-9 mol·L-1;c02(OH-)=
,c(OH-)=10-9 mol·L-1;c02(OH-)= mol·L-1,c0(OH-)=10-8 mol·L-1;(3)甲与乙的区别就是是否有CO32-生成,本题就转化为检验溶液中是否有CO32-。
mol·L-1,c0(OH-)=10-8 mol·L-1;(3)甲与乙的区别就是是否有CO32-生成,本题就转化为检验溶液中是否有CO32-。


科目:高中化学 来源:2014年高考化学二轮复习专题滚动练4 化学实验练习卷(解析版) 题型:选择题
在下列溶液中,各组离子一定能够大量共存的是( )
A.能使广泛pH试纸显蓝色的溶液:K+、Ba2+、Cl-、Br-
B.常温下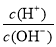 =1012的溶液:Fe2+、Mg2+、NO3-、Cl-
=1012的溶液:Fe2+、Mg2+、NO3-、Cl-
C.含有大量Al3+的溶液:Na+、Cl-、AlO2-、OH-
D.能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32-
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习专题滚动练1 化学基本概念练习卷(解析版) 题型:选择题
NA表示阿伏加德罗常数的值,下列说法正确的是( )
①用铜作电极电解饱和NaCl溶液,当线路中通过NA个电子时,阳极产生11.2 L气体(标准状况下) ②常温常压下,16 g O2和16 g O3含氧原子数均为NA ③标准状况下,22.4 L CH3CH2OH中含有的碳原子数为2NA ④6.5 g锌全部溶于一定量的浓硫酸,生成SO2与H2的混合气体,气体分子总数为0.1NA ⑤10.6 g Na2CO3粉末中含有CO32-数为0.1NA
A.②④⑤ B.①③⑤
C.①②④⑤ D.①②③
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后训练专题练习卷二(解析版) 题型:选择题
下列说法正确的是( )
A.乙烯和乙烷都能发生加聚反应
B.蛋白质水解的最终产物是多肽
C.米酒变酸的过程涉及了氧化反应
D.石油裂解和油脂皂化都是由高分子生成小分子的过程
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后训练专题练习卷二(解析版) 题型:选择题
某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图所示,电池总反
应可表示为2H2+O2=2H2O,下列有关说法正确的是( )
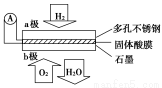
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为O2+2H2O+4e-=4OH-
C.每转移0.1 mol电子,消耗1.12 L的H2
D.H+由a极通过固体酸电解质传递到b极
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后训练专题练习卷一(解析版) 题型:填空题
能源危机促使世界各国寻找新的替代能源和开展对已有能源“高效利用”的技术研发。设计燃料电池使汽油氧化直接产生电流是本世纪最富有挑战性的课题之一。以丁烷(已知丁烷的燃烧热为2 877.6 kJ·mol-1)为代表回答下列问题:
(1)写出丁烷燃烧的热化学方程式:________________;
(2)正丁烷的燃烧热:2 878 kJ·mol-1,异丁烷的燃烧热:2 869 kJ·mol-,正丁烷转化为异丁烷的过程中________(填“放出”或“吸收”)能量。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后训练专题练习卷一(解析版) 题型:填空题
已知A、B、C、D、E、F、G、H可以发生如图所示的转化,反应中部分生成物已略去。其中,A、G为同一主族元素的单质,B、C、H在通常情况下为气体,化合物C是一种形成酸雨的大气污染物。
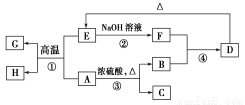
请完成以下填空:
(1)H的名称是________。
(2)E的两种用途是________、________。
(3)反应③的化学方程式是________。
(4)反应④的离子方程式是________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练9-2练习卷(解析版) 题型:填空题
某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾。
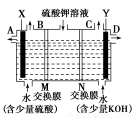
(1)X极与电源的 (填“正”或“负”)极相连,氢气从 (选填“A”、“B”、“C”或“D”)口导出。
(2)离子交换膜只允许一类离子通过,则M为 (填“阴离子”或“阳离子”,下同)交换膜,N为 交换膜。
(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池负极的电极反应式为 。
(4)若在标准状况下,制得11.2 L氢气,则生成硫酸的质量是 ,转移的电子数为 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练8-3练习卷(解析版) 题型:填空题
常温下,如果取0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因(用离子方程式表示): 。
(2)混合溶液中由水电离出的c(OH-) (填“>”、“<”或“=”)0.1 mol·L-1 NaOH溶液中由水电离出的c(OH-)。
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):c(Na+)-c(A-)= mol·L-1,c(OH-)-c(HA)= mol·L-1。
(4)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填“>”、“<”或“=”);将同温度下等浓度的四种盐溶液:
A.NH4HCO3 B.NH4A C.(NH4)2SO4 D.NH4Cl
按pH由大到小的顺序排列是 (填序号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com