
【题目】某化工厂生产的某产品A只含C、H、O三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等). 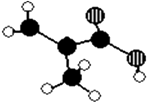
(1)该产品的结构简式为 , 含有的官能团名称 ,
(2)该化合物的核磁共振氢谱中有个吸收峰.
(3)(填序号)下列物质中,与A互为同分异构体的是 , 与A互为同系物的是 ①CH3CH=CHCOOH ②CH2=CHCOOCH3
③CH3CH2CH=CHCOOH ④CH3CH(CH3)COOH
(4)写出该物质与甲醇反应的化学方程式: .
【答案】
(1)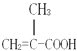 ;碳碳双键;羧基
;碳碳双键;羧基
(2)3
(3)①②;③
(4)
【解析】解:(1)该物质的结构简式为 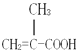 ;含有官能团是碳碳双键和羧基,所以答案是:
;含有官能团是碳碳双键和羧基,所以答案是: 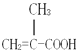 ;碳碳双键和羧基;(2)有几种氢原子其核磁共振氢谱中就有几个吸收峰,该分子中含有3种氢原子,所以有3个吸收峰,所以答案是:3;(3)分子式相同、结构不同的有机物互称同分异构体;结构相似、在分子组成上相差一个或n个﹣CH2原子团的有机物互称同系物,所以互为同分异构体的是①②,互为同系物的是③,所以答案是:①②;③;(4)在浓硫酸作催化剂、加热条件下,该物质和甲醇发生酯化反应,反应方程式为
;碳碳双键和羧基;(2)有几种氢原子其核磁共振氢谱中就有几个吸收峰,该分子中含有3种氢原子,所以有3个吸收峰,所以答案是:3;(3)分子式相同、结构不同的有机物互称同分异构体;结构相似、在分子组成上相差一个或n个﹣CH2原子团的有机物互称同系物,所以互为同分异构体的是①②,互为同系物的是③,所以答案是:①②;③;(4)在浓硫酸作催化剂、加热条件下,该物质和甲醇发生酯化反应,反应方程式为  ,
,
所以答案是:  .
.
【考点精析】利用有机物的结构和性质对题目进行判断即可得到答案,需要熟知有机物的性质特点:难溶于水,易溶于汽油、酒精、苯等有机溶剂;多为非电解质,不易导电;多数熔沸点较低;多数易燃烧,易分解.


科目:高中化学 来源: 题型:
【题目】下列实验操作中,错误的是( )
A. 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B. 过滤可以除掉粗盐中可溶于水的杂质
C. 碘易溶于有机溶剂,可用CCl4萃取碘水中的碘
D. 用托盘天平称量固体药品时,砝码放在右盘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2014年诺贝尔物理学奖得主的贡献是发明了一种高效而环保的光源﹣﹣蓝色发光二极管(LED).某同学对此非常感兴趣,请你帮助某同学完成资料收集的工作.
(1)LED研究起始于对碳化硅晶体的研究.1907年,英国科学家Henry Joseph Round发现在施加电流时能够在碳化硅晶体中发现发光现象. (i)碳化硅晶体属于晶体.
(ii)碳化硅的晶胞结构与金刚石的相似,在碳化硅晶体中,碳原子所连接最小的环由个碳原子和个硅原子组成,每个碳原子连接个这样的环.
(iii)碳化硅中,碳原子采取杂化方式,与周围的硅原子形成的键角为 .
(iv)请结合原子结构的知识解释发光的原因: .
(2)准现代LED.1962年,GE公司使用磷砷化镓(GaAsxP1﹣x)材料制成了红色发光二极管.这是第一颗可见光LED,被视为现代LED之祖.随后又出现了绿色LED磷化镓(GaP)和黄色LED碳化硅,使光谱拓展到橙光、黄光和绿光. (i)镓在元素周期表的位置是 , 其基态原子的价电子排布式为 .
(ii)人们发现在磷砷化镓或磷化镓中掺杂氮(利用氮代替磷或砷的位置),可以提高其发光效率.其原因不可能为(多选).
A、氮的半径比磷和砷的半径小,用氮代替部分磷或砷的位置不会影响晶体的构型.
B、N的第一电离能大于磷和砷,容易失去电子,发生电子跃迁.
C、N的电负性大,掺杂后得到的位置中存在氢键.
D、N是与砷、磷具有相同价电子结构的杂质,但对电子束缚能力较磷和砷强,造成等电子陷阱.
(3)1993年,中村修二等人开发出首个明亮蓝光的氮化镓LED.凭借此成就,他获得了2014年诺贝尔物理学奖. 为测试氮化镓绿色LED光强与电流的关系,得到如图,从图中你能得到规律(写一条即可)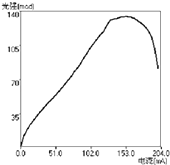
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数,下列叙述中正确的是( )
A.在标准状况下,1L庚烷完全燃烧后,所生成的气态产物的分子数为 ![]() NA
NA
B.1mol碳正离子CH5+所含的电子数为10NA
C.标准状况下,16g甲烷完全燃烧所消耗的氧气的分子数的3NA
D.0.5molC3H8分子中含C﹣H共价键2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用如下装置(支撑仪器略去)探究乙醇的催化氧化反应和乙醛的性质. 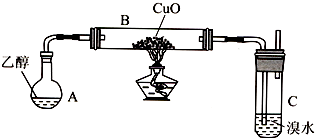
(1)实验开始时,对A进行水浴加热,其目的是 .
(2)B中反应方程式为 .
(3)若装置C中开始发生倒吸,则采取的应急措施是(填编号).
A.移去图中的酒精灯
B.将C中橡皮塞上的短导气管拔出
C.将B尾端的乳胶管取下
D.将A与B之间的乳胶管取下
(4)探究:充分反应后,观察到溴水完全褪色.学习小组通过测定反应前溴水中n(Br2)与反应后溶液中n(Br﹣)来确定乙醛使溴水褪色的原因. ①假设.请写出假设1的反应类型.
假设1:CH3CHO+Br2→CH2BrCHO+HBr;反应
假设2:CH3CHO+Br2→CH3CHBrOBr; 加成反应
假设3:CH3CHO+Br2+H2O→CH3COOH+2HBr. 氧化反应
②结论:若实验测得n(Br2)=0.005mol,n(Br﹣)=0.01mol,则证明假设正确.
(5)欲检验乙醇中混有的少量乙醛,甲乙丙三同学设计实验如表:
试剂、用品 | 预期现象 | |
甲 | 酸性高锰酸钾溶液 | 溶液紫红色褪去 |
乙 | 溴水 | 溴水褪色 |
丙 | 铜丝 酒精灯 | 铜丝由黑色变成光亮的红色 |
则上述方案中你认为能正确完成乙醛的检验的是(填甲、乙、丙)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】容积均为2L的甲乙丙三个恒容密闭容器中均加入0.10mol/L的N2、0.26mol/L的H2 , 进行合成氨反应:N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJ/mol.图1表示不同反应条件下N2的浓度随时间的变化,图2表示其它条件相同,温度分别为T1、T2、T3且恒定不变,达到平衡时NH3的质量分数.下列判断不正确的是( ) 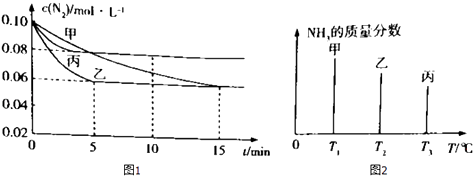
A.图2 中反应速率最快的是容器丙
B.图1 中容器乙的反应可能使用了催化剂
C.图1 中容器乙0~5 min时间内v ![]() =0.012mol/(L?min)
=0.012mol/(L?min)
D.图1 中容器丙内反应的平衡常数为2.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中c(Cl-)最大的是
A. 65mL1mol/L的KCl溶液 B. 25mL3mol/L的NaCl溶液
C. 20mL2mol/L的MgCl2溶液 D. 10mL1.5mol/L的AlCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式不正确的是( )
A.醋酸溶于水:CH3COOH═CH3COO﹣+H+
B.Na2SO4溶于水:Na2SO4═2Na++SO42﹣
C.碳酸氢钠溶于水:NaHCO3═HCO3﹣+Na+
D.次氯酸溶于水:HClOH++ClO﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com