
在工业生产硫酸中,吸收塔内用来吸收三氧化硫的物质是
A.H2O B.稀H2SO4 C.浓H2SO4 D.NH3·H2O
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
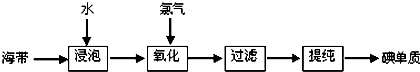
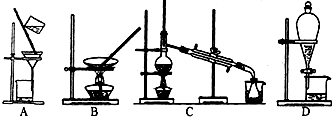
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江西省南昌市高三第三次模拟测试理综化学部分 题型:实验题
黄铁矿是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对某黄铁矿石(主要成 分为FeS2)进行硫元素含量测定的实验探究及工业生产硫酸的探究.
I.将m1g该黄铁矿样品(杂质中不含硫和铁)放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通人空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O2→2 Fe2O3+8SO2(高温)

Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理:

问题讨论:
(1)1中,甲瓶内所盛试剂是 溶液。乙瓶内发生反应的离子方程式有
、 。
(2)Ⅱ中,所加H2O2溶液需足量的理由是 。
(3)该黄铁矿石中硫元素的质量分数为 。
(4)在硫酸工业中,通过下列反应使二氧化硫转化为三氧化硫:
 在实际工业生产中,常采用“二转 二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为 。
在实际工业生产中,常采用“二转 二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为 。
(5)硫酸的工业制法过程涉及三个主要的化学反应及相应的设备(沸腾炉、转化器、吸收塔)。
①三个设备分别使反应物之间或冷热气体间进行了“对流”。请简单描述吸收塔中反应物之间是怎样对流的 。
②工业生产中常用氨一酸法进行尾气脱硫,以达到消除污染、废物利用的目的,用化学方程式表示其反应原理。(只写出2个方程式即可)
查看答案和解析>>
科目:高中化学 来源:广东省模拟题 题型:填空题
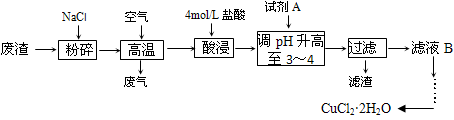
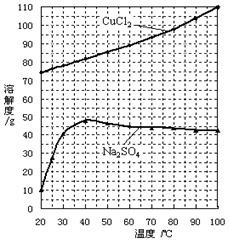
查看答案和解析>>
科目:高中化学 来源: 题型:
黄铁矿是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对某黄铁矿石(主要成 分为FeS2)进行硫元素含量测定的实验探究及工业生产硫酸的探究.
I.将m1g该黄铁矿样品(杂质中不含硫和铁)放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通人空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O2→2 Fe2O3+8SO2(高温)
Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理:
问题讨论:
(1)1中,甲瓶内所盛试剂是 溶液。乙瓶内发生反应的离子方程式有
、 。
(2)Ⅱ中,所加H2O2溶液需足量的理由是 。
(3)该黄铁矿石中硫元素的质量分数为 。
(4)在硫酸工业中,通过下列反应使二氧化硫转化为三氧化硫:
在实际工业生产中,常采用“二转 二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为 。
(5)硫酸的工业制法过程涉及三个主要的化学反应及相应的设备(沸腾炉、转化器、吸收塔)。
①三个设备分别使反应物之间或冷热气体间进行了“对流”。请简单描述吸收塔中反应物之间是怎样对流的 。
②工业生产中常用氨一酸法进行尾气脱硫,以达到消除污染、废物利用的目的,用化学方程式表示其反应原理。(只写出2个方程式即可)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com