
【题目】下列叙述正确的是( )
A.在同温同压下,甲容器中的氧气(O2)和乙容器中的氨气(NH3)所含的原子个数相同,则甲、乙两容器中气体的体积之比为1:2
B.任何条件下,等物质的量的甲烷(CH4)和一氧化碳所含的原子数一定相等
C.在标准状况时,20mL NH3与60mL N2所含的原子个数比为1:3
D.同温同压下,1L一氧化碳气体一定比1L氧气的质量小
科目:高中化学 来源: 题型:
【题目】在1.0 L密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)![]() Y(g)+Z(g) H<0容器内气体总压强p随反应时间t的变化关系如下图所示。以下分析正确的是
Y(g)+Z(g) H<0容器内气体总压强p随反应时间t的变化关系如下图所示。以下分析正确的是
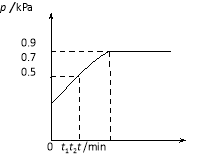
A.从反应开始到t1时的平均反应速率
v(X)=![]() mol/(L·min)
mol/(L·min)
B.该温度下此反应的平衡常数K=0.32
C.欲提高平衡体系中Y的含量,可升高体系温度或减少Z的量
D.其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KC1样品中含有少量K2CO3、K2SO4和不溶于水的杂质,为了提纯KC1,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作:
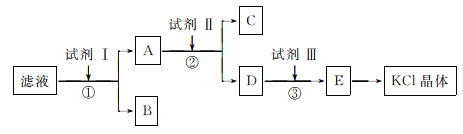
回答下列问题:
(1)为检验起始滤液中的Cl-,所用试剂除了稀硝酸,还需要_____________溶液。
(2)试剂I的化学式为________________,判断试剂I已加过量的方法是_____________。
(3)试剂Ⅱ的化学式为__________________,②中加入试剂Ⅱ的目的是__________________。
(4)试剂Ⅲ的名称是__________,③中发生反应的离子方程式为________________。
(5)某同学根据最终所得KC1晶体质量和原样品的质量计算出氯化钾样品的纯度,你认为结果可靠吗?并说明理由(不考虑实验误差):__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有饱和碳酸钠溶液的烧杯中,插入惰性电极,接通直流电源,保持温度不变,一定时间后,
溶液中( )
A.Na2CO3浓度减小
B.Na2CO3浓度增大
C.Na2CO3浓度增大,并有晶体析出
D.Na2CO3浓度不变,并有晶体析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应:A(g) +3B(g) ![]() 2C(g)。若维持温度和压强不变,当达到平衡时容器的体积为V,其中C气体的体积占10%。下列推断正确的是
2C(g)。若维持温度和压强不变,当达到平衡时容器的体积为V,其中C气体的体积占10%。下列推断正确的是
A.原混合气体的体积为1.2V B.原混合气体的体积为1.1V
C.反应达平衡时气体B消耗掉0.05V D.反应达到平衡时气体A消耗掉0.05V
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
请回答下列问题:
(1)上述仪器中,在配制稀盐酸时需要使用的有______________________(填序号),还缺少的仪器是______________(填仪器名称)。
(2)计算:所需浓盐酸的物质的量浓度为___________,量取浓盐酸的体积为_________mL。量取浓盐酸时应选用量筒的规格为___________。
①10 mL ②50 mL ③100 mL
(3)将所配制的稀盐酸进行测定,发现浓度大于0.8mol/L。请你分析配制过程中可能引起浓度偏高的原因(答出两点) 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了证明SO2和Cl2的漂白性,设计了如下图所示的实验装置:
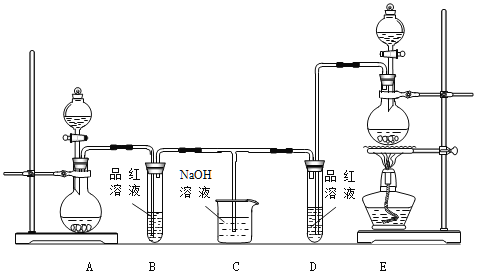
(1)他们制备Cl2依据的原理是:MnO2 + 4HCl(浓)![]() MnCl2 + 2H2O + Cl2↑,应选用上图A、E装置中的 (填序号)制Cl2,反应中浓盐酸所表现出的性质是 、 。
MnCl2 + 2H2O + Cl2↑,应选用上图A、E装置中的 (填序号)制Cl2,反应中浓盐酸所表现出的性质是 、 。
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的液体加热,B试管中的现象是 。
(3)NaOH溶液分别与两种气体反应的离子方程式是 、 。
(4)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中均含杂质(括号中是杂质),除杂质方错误的是
A. 碳酸钠(碳酸氢钠):加热,直到质量不再减少为止
B. 溴苯(溴):加入氢氧化钠溶液洗涤,分液
C. 乙醇(乙醛):加入新制氢氧化铜煮沸,过滤
D. 乙酸丁酯(乙酸):加入碳酸钠溶液洗涤,分液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com