
【题目】下列说法正确的是( )
A. 加入铝粉能产生H2的溶液中,可能存在大量的Na+、Ba2+、AlO2-、NO3-
B. 某温度下,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液一定显中性
C. 向苯和少量苯酚的混合溶液中加入适量浓溴水,过滤,可除去苯中少量苯酚
D. 已知I3-![]() I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是( )

A. 微生物促进了反应中电子的转移
B. 正极反应中有CO2生成
C. 质子通过交换膜从负极区移向正极区
D. 电池总反应为C6H12O6+6O2===6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将盐酸溶液滴加到联氨(N2H4)的水溶液中,混合溶液中的微粒的物质的量分数δ(X)随-1g(OH-)变化的关系如图所示。下列叙述错误的是
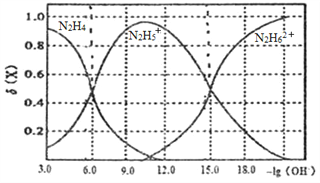
A. 反应N2H62++N2H4=2N2H5+的pK=90(已知pK=-lgK)
B. N2H5Cl溶液中存在:c(Cl-)+c(OH-)=c(N2H5+)+2c(N2H62+)+c(H+)
C. N2H5Cl溶液中c(H+)>c(OH-)
D. Kb1(N2H4)=10-6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C、F是无色无味的气体,H是白色沉淀,W溶液中滴加KSCN溶液出现血红色。

(1)物质A的化学式为 ________,F化学式为 ________;
(2)B和R在溶液中反应生成F的离子方程式为__________________________;
(3)H在潮湿空气中变成M的实验现象是________,化学方程式为______________;
(4)A和水反应生成B和C的化学方程式为__________________________,由此反应可知A有作为_________的用途;
(5)W溶液中滴加KSCN溶液出现血红色的离子方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知伞形酮可用雷琐苯乙酮和苹果酸在一定条件下反应制得。
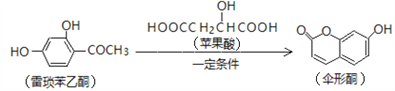
下列说法中正确的是
A. 1mol雷琐苯乙酮最多能与3mol Br2发生取代反应
B. 苹果酸能形成一种缩聚产物是![]()
C. 1mol伞形酮与足量NaOH溶液反应,最多可消耗2mol NaOH
D. 雷琐苯乙酮、苹果酸、伞形酮都能跟FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(1)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①假设用酸性高锰酸钾溶液吸收煤燃烧产生的SO2,该过程中高锰酸根被还原为Mn2+,请写出该过程的离子方程式______________。
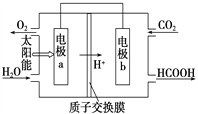
②将燃煤产生的二氧化碳加以回收,可降低碳的排放。左图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图,a电极名称:_____________(填“正极”或“负极”),b电极的反应式:________________________。
(2)如果采用NaClO、Ca(ClO)2作吸收剂,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是___________。
②已知下列反应:
SO2(g)+2OH (aq) ==SO32 (aq)+H2O(l) ΔH1
ClO (aq)+SO32 (aq) ==SO42 (aq)+Cl (aq) ΔH2
CaSO4(s) ==Ca2+(aq)+SO42(aq) ΔH3
则反应SO2(g)+ Ca2+(aq)+ ClO (aq) +2OH (aq) = CaSO4(s) +H2O(l) +Cl (aq)的ΔH=_____。
II.(3)FeO![]() 在水溶液中的存在形态如图所示。
在水溶液中的存在形态如图所示。
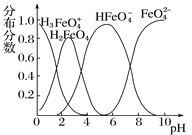
①若向pH=10的这种溶液中加硫酸至pH=2,HFeO![]() 的分布分数的变化情况是__________。
的分布分数的变化情况是__________。
②若向pH=6的这种溶液中滴加KOH溶液,则溶液中含铁元素的微粒中,_________转化为_________(填微粒符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成:

已知:RX![]() ROH;RCHO+CH3COOR’
ROH;RCHO+CH3COOR’![]() RCH=CHCOOR’ 请回答:
RCH=CHCOOR’ 请回答:
(1) A中官能团的名称是______________________。
(2) D→E的化学方程式________________________________________________。
(3) X的结构简式_________________。
(4)与F互为同分异构体又满足下列条件的有_______种。
①遇到氯化铁溶液会显紫色,②会发生银镜反应 ③苯环上有三个取代基
在其它同分异构体中核磁共振氢谱有六组峰,氢原子数比符合1:2:2:2:2:1的结构为_____。
(5)根据上面合成信息及试剂,写出以乙烯为原料(无机试剂任选),写出合成CH3CH=CHCOOCH2CH3路线。_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】因在航空、核能、电池等高技术领域的重要作用——锂被称为“21世纪的能源金属”。完成下列填空:
(1)锂位于元素周期表的________。锂的很多化学性质与镁相似,请依据元素周期律进行解释:_________。
(2)氢化锂(LiH)是离子化合物,写出其阴离子的电子式_______________,LiH中阴离子半径大于阳离子半径,其原因是__________________________________________________。
(3) 工业上用Li2CO3制取锂的化合物及金属锂。碳原子核外电子有________种不同能量的电子,其中有两个电子的能量最高且能量相等,这两个电子所处的轨道是_____________________。
(4)用Li2CO3、氨水和液溴制备LiBr·H2O的流程如下:

①合成时,除生成LiBr外,还产生了两种参与大气循环的气体,补全产物并配平该反应的化学方程式:
Li2CO3+Br2+ NH3·H2O→LiBr+(___) __________。
②溴化锂的溶解度随温度变化曲线如图所示,请补全从溶液中得到LiBr·H2O晶体的实验步骤:_____、过滤、用乙醇洗涤,干燥。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界能源消费的90%以上依靠化学技术。
(1)工业制氢的一个重要反应是利用CO还原H2O(g)。已知:
C(石墨,s)+O2(g)===CO2(g) ΔH=-394 kJ·mol-1
2C(石墨,s)+O2(g)===2CO(g) ΔH=-222 kJ·mol-1
H2(g)+![]() O2(g)===H2O(g) ΔH=-242 kJ·mol-1
O2(g)===H2O(g) ΔH=-242 kJ·mol-1
则CO还原H2O(g)的热化学方程式为__________________。
(2)氢能被视为最具发展潜力的绿色能源,写出碱式氢氧燃料电池工作时的负极电极反应式:______________________________________________________________。
(3)一种新型锂离子二次电池——磷酸铁锂(LiFePO4)电池。作为正极材料的磷酸铁锂在充、放电时的局部放大示意图如下图,写出该电池充电时的阳极电极反应式:___________。
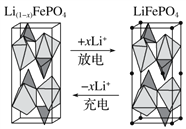
(4)LiOH是制备锂离子电池正极材料的重要原料,其电解法制备装置如下图。气体a通入淀粉KI溶液中,发现溶液变蓝,持续一段时间后,蓝色逐渐褪去。则M极为电源的_______(填“正”或“负”)极,B极区电解液为_______(填化学式)溶液,该离子交换膜是_______(填“阳”或“阴”)离子交换膜,解释蓝色褪去的原因_________________________________。
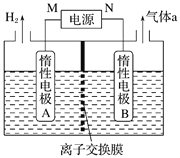
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com