
若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,可能共存的是
A. NH4+、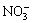 、
、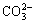 、Na+ B. Ba2+、Mg2+、
、Na+ B. Ba2+、Mg2+、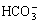 、
、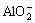
C. 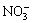 、Ca2+、K+、Cl- D.
、Ca2+、K+、Cl- D. 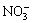 、K+、
、K+、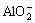 、OH-
、OH-
 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
甲、乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况。
| 步骤 | 操作 | 现象 |
| I | 向2 mL 1 mol·L-1FeCl3溶液中加入一定量的Na2SO3溶液 | 溶液由棕黄色变为红褐色, 并有少量刺激性气味的气体逸出 |
(1)常温下,FeCl3溶液的pH_______7(填“<”、“>”或“=”)。
(2)分析红褐色产生的原因。
① 甲同学认为步骤I中溶液呈红褐色是因为生成了Fe(OH)3,用化学平衡移动原理解释溶液呈红褐色的原因:________。
 ② 乙同学认为可能是发生了氧化还原反应,完成并配平其反应的离子方程式:
② 乙同学认为可能是发生了氧化还原反应,完成并配平其反应的离子方程式:





 Fe3+ + SO32- + == F e2+ + +
Fe3+ + SO32- + == F e2+ + +
乙同学查阅资料得知:
| 1.Fe2+与SO32-反应生成墨绿色的絮状沉淀FeSO3; 2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色。 |
(3)甲同学为了确认溶液呈红褐色的原因是生成了Fe(OH)3,设计并完成如下实验:
| 步骤 | 操作 | 现象 |
| II | 用激光笔照射步骤I中的红褐色溶液 | 出现“丁达尔效应” |
甲同学因此得出结论:溶液呈红褐色是因为生成了Fe(OH)3。而乙同学认为甲同学得出结论的证据仍然不足,乙同学的理由是________。
(4)进一步确认Na2SO3溶液与FeCl3溶液反应的情况,乙同学设计并完成如下实验:
| 步骤 | 操作 | 现象 |
| III | 向1 mol•L-1的FeCl3溶液中通入一定量的SO2 | 溶液由黄色变为红褐色 |
| IV | 用激光笔照射步骤III中的红褐色溶液 | 没有出现“丁达尔效应” |
① 经检验步骤III中红褐色溶液含有Fe2+,检验Fe2+选用的试剂是______(填字母)。
a.K3 溶液 b.KSCN溶液 c.KMnO4溶液
② 已知H2SO3是弱酸,请结合电离方程式说明步骤III中出现红褐色的原因: 。
(5)结论:由上述实验得知,甲、乙两同学所持观点均正确。
查看答案和解析>>
科目:高中化学 来源: 题型:
经测定某溶液中只含NH4+、C1-、H+、OH-四种离子,下列说法错误的是
A.若溶液中粒子间满足:c(NH4+)>c(C1-)>c(OH-)>c(H+)则溶液中溶质一定为:NH4Cl和NH3·H2O
B.溶液中四种粒子之间不可能满足:c(C1-)>c(H+)>c(NH4+)>c(OH-)
C.若溶液中粒子间满足:c(C1-)>c(NH4+)>c(H+)>c(OH-)溶液中溶质一定只有NH4Cl
D.若溶液中c(NH4+)=c(Cl-),则该溶液一定显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能含有I-、NH4+、Na+、SO32-,向该溶液中加入少量溴水,溶液仍成无色,则下列关于溶液组成判断正确的是:
①肯定不含I-;②肯定不含Na+;③肯定含SO32-;④可能含有I-
A. ①③ B. ①②③ C. ②③④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
有一无色未知溶液中检验出有Ba2+、Ag+,同时又测得其酸性很强。某学生还要鉴定此溶液中是否大量存在:①Cu2+ ;②Fe3+;③Cl-;④NO3-;⑤S2-;⑥CO32-;⑦NH4+;⑧Mg2+;⑨AI3+⑩AlO2-。其实,这些离子中有一部分不必再鉴定就能加以否定,你认为不必鉴定的离子组是
A.③⑤⑥⑦⑩ B.①②⑤⑥⑧⑨ C.③④①⑧⑨ D.①②③⑤⑥⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
在FeCl3和Fe2(SO4)3的混合溶液中,若不计Fe3+的水解,当溶液中c(Fe3+)= c(SO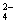 )时,下列判断正确的是
)时,下列判断正确的是
A.c(Fe3+)>c(Cl-) B.c(SO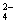 )>c(Cl-)
)>c(Cl-)
C.c(SO42-)<c(Cl-) D.FeCl3和Fe2(SO4)3的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A==H++HA;HA-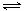 H++A2- 回答下列问题:
H++A2- 回答下列问题:
⑴Na2A溶液显(填“酸性”,“中性”,或“碱性”)。
理由是: (用离子方程式表示)
⑵在0.1mol·L-1的Na2A溶液中,下列微粒浓度关系式正确的是: 。
A. c(A2-) +c( HA-)+c( H2A) =0.1mol·L-1 B. c(OH-)=c(H+) +c( HA-)
C. c(Na+ )+ c(H+) =c(OH-)+ c( HA-)+2c(A2-) D. c(Na+ )= 2c(A2-) +2c( HA-)
⑶已知0.1mol·L-1NaHA溶液的pH=2,则0.1mol·L-1 H2A溶液中氢离子的物质的量浓度可能是 < 0.11 mol·L-1(填“<”,“>”,或“=”),理由是: 。
⑷0.1mol·L-1 NaHA溶液中各种离子浓度由大到小的顺序是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
氧元素是地壳中含量最多的元素。下列说法中正确的是( )
A.16O2与18O3互为同位素
B.氧元素与其他短周期非金属元素均能形成酸性氧化物
C.氧与钠形成的稳定化合物中,阴、阳离子个数比均为1∶2
D.O2变成O3以及16O变成18O的变化均属于化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
有下列各组微粒或物质:
A.O2和O3
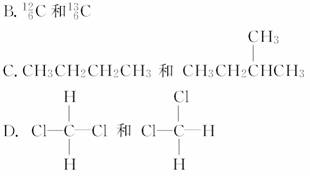
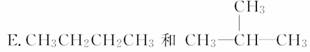
(1)________组两种微粒互为同位素。
(2)________组两种物质互为同素异形体。
(3)________组两种物质属于同系物。
(4)________组两物质互为同分异构体。
(5)________组两物质是同一物质。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com