
| 主族 周期 | IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅤⅡA | O |
| 2 | b | h | c | |||||
| 3 | d | i | g | j | e | a | ||
| 4 | f |
 ;
;分析 由元素在周期表中的位置可知a~j分别为Ar、C、O、Na、Cl、Ca、Si、N、Mg、S等,
(1)同周期自左而右金属性减弱,同主族自上而下金属性增强,结合金属活动顺序表判断;
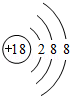
(2)Ar原子质子数为18,核外电子数为18,有3个电子层,各层电子数为2、8、8;
(3)最外层电子数一样时,核电荷数越小,离子的半径越大;
(4)二氧化硅可以制造光导纤维;
(5)c、d的单质在加热条件下生成物质为过氧化钠;
(6)由其中某种元素的最高价氧化物对应的水化物与其最低价氢化物反应生成的化合物为硝酸铵.
解答 解:由元素在周期表中的位置可知a~j分别为Ar、C、O、Na、Cl、Ca、Si、N、Mg、S等,
(1)同周期自左而右金属性减弱,同主族自上而下金属性增强,结合计算活动顺序表可知,钙的金属性最强,故答案为:钙;
(2)a为Ar,Ar原子质子数为18,核外电子数为18,有3个电子层,各层电子数为2、8、8,原子结构示意图为 ,
,
故答案为: ;
;
(3)由于的核外电子数相等,即Ca2+、Cl-、S2-的核外电子排布相同,故核电荷数越大,半径越小,即离子的半径由小到大的顺序是:Ca2+<Cl-<S2-,
故答案为:Ca2+<Cl-<S2-;
(4)二氧化硅可以制造光导纤维,故答案为:光导纤维;
(5)O元素与Na形成的特殊氧化物为过氧化钠,化学式为:Na2O2,由钠离子与过氧根离子构成,该物质中阳离子与阴离子个数比为2:1,
故答案为:离子键、共价键;1:2;
(6)由其中某种元素的最高价氧化物对应的水化物与其最低价氢化物反应生成的化合物为硝酸铵,方程式为NH3+HNO3=NH4NO3,故答案为:NH3+HNO3=NH4NO3.
点评 本题考查元素周期表、化学用语、元素化合物性质等,为高考常见题型,比较基础,旨在考查学生对基础知识的理解掌握,注意整体把握元素周期表的结构.


科目:高中化学 来源: 题型:选择题
| A. | 氯化氢溶于水的过程属于放热反应 | |
| B. | 有化学键断裂的过程一定属于化学反应 | |
| C. | 物质导电的过程一定是物理变化 | |
| D. | 同分异构体之间的相互转化一定是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有共价键的化合物就是共价化合物 | |
| B. | 离子化合物不可能全部由非金属构成 | |
| C. | H2O比H2S的沸点高是由于H2O中的O-H键更牢固 | |
| D. | 寻找半导体材料可以在元素周期表的金属与非金属的分界线附近寻找 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧元素的相对原子质量为$\frac{12a}{b}$ | B. | 1mol该氧原子质量为aNAg | ||
| C. | xg该氧原子所含的电子数为8xNA | D. | yg该氧原子的中子数一定为$\frac{8y}{a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | 化学键的类型 | 物质分类 | 溶于水时破坏的化学键的类型 |
| Na2S | |||
| HCl | |||
| (NH4)2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质溶液的导电能力一定比弱电解质溶液的强 | |
| B. | 氨气是弱电解质,铜是强电解质 | |
| C. | 氧化钠是强电解质,醋酸是弱电解质 | |
| D. | 硫酸钠是强电解质,硫酸钡是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
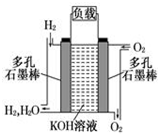 如图为氢氧燃料碱性电池,电极材料为疏松多孔石墨棒.根据所学知识试回
如图为氢氧燃料碱性电池,电极材料为疏松多孔石墨棒.根据所学知识试回查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,A和E元素形成的化合物所含有的化学键是离子键.
,A和E元素形成的化合物所含有的化学键是离子键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蚕丝、羊毛、病毒等主要成分都是蛋白质 | |
| B. | 蛋白质溶液中加入饱和(NH4)2SO4溶液,蛋白质析出,再加水,也不溶解 | |
| C. | 重金属盐能使蛋白质凝结 | |
| D. | 浓硝酸使皮肤呈黄色是由于浓硝酸与蛋白质发生了颜色反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com