
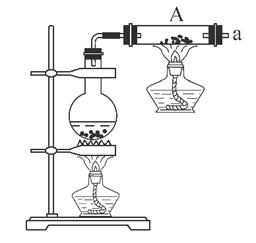
(1)铁粉与水蒸气反应的化学方程式是: ;
(2)为检验生成的气体产物,需从下图选择必要的装置,其正确的连接顺序为(用接口字母表示)a— ,描述能证明气体产物的实验现象_ ;
(3)停止反应,待装置冷却后,取出反应过的铁粉混合物,加入过量的稀硫酸充分反应。过滤。简述检验所得滤液中Fe3+的操作方法: ;
(4)经检验上述滤液中不含Fe3+,这不能说明铁粉与水蒸气反应所得产物中不含+3价的铁。原因是(用化学方程式说明): ;
(5)某同学利用上述滤液制取白色的Fe(OH)2沉淀,向滤液中加入NaOH溶液后,观察到生成的白色沉淀迅速变成灰绿色,最后变成红褐色。
①沉淀由白色变为红褐色的化学方程式是: ;
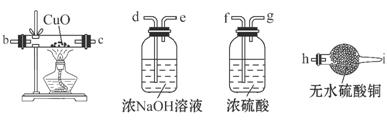
②为了得到白色的Fe(OH)2沉淀,并尽可能使沉淀长时间保持白色,有同学设计如下图所示的装置: 通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是________(填序号)。
通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是________(填序号)。
A.电源中的a为正极,b为负极 B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极 D.阴极发生的反应是2H++2e-===H2↑
【知识点】化学实验 J1 J5 C3 F4
【答案解析】(每空2分)(1)Fe+4H2O(g) = Fe3O4+4H2
(2)a—f—g—b—c—h或a—f—g—c—b—h。
黑色的氧化铜变成红色,白色的无水CuSO4变成蓝色
(3)滴加KSCN溶液,溶液变红色
(4)2Fe3++Fe=2Fe2+
(5)①4Fe(OH)2+O2+2H2O═4Fe(OH)3 ②ABD
解析:⑴铁粉与水蒸气反应生成四氧化三铁和氢气
⑵用A盛放铁粉,用B制取水蒸气,铁和水蒸气反应后有部分水蒸气剩余,所以a出来的气体通过浓硫酸进行干燥,洗气瓶中的导气管应该是长进短出,所以a连接f,f连接g,干燥后的氢气进入C装置,可以从b进入,也可以从c进入,所以g可以连接b或c,氧化铜和氢气反应有水蒸气生成,水能使无水硫酸铜变蓝,所以c或b连接h,因此其排序为:afgbch 或afgcbh,当看到无水硫酸铜变蓝,黑色的氧化铜变成红色,则生成的气体是氢气。
⑶Fe3+的检验用KSCN,即滴加KSCN溶液,溶液变红色
⑷固体产物含有四氧化三铁和未反应的铁,四氧化三铁和铁都与盐酸反应生成盐,而且铁与铁离子反应生成Fe2+导致滤液中检验不出Fe3+
⑸①Fe(OH)2被空气中的氧气氧化为氢氧化铁②欲溶液中产生大量的白色沉淀,且较长时间不变色,即利用生成的氢气从上到下排除溶液中的氧气,即B端是阴极,b是负极,阴极材料可以是铁也可以是其它能导电的材料,阴极方程式为:2H++2e-=H2↑,因为氢离子放电破坏水的电离平衡,使氢氧根离子浓度增大,与亚铁离子结合成Fe(OH)2沉淀,金属Fe作阳极,阳极方程式为:Fe-2e-=Fe2+。因此选ABD。
【思路点拨】装置的连接顺序一般是发生装置→除杂→干燥→性质实验→尾气处理。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
(Ⅰ)某化学实验小组为确定过氧化氢分解的最佳催化条件,用如图装置进行实验,反应物用量和反应停止的时间数据如下表:
|
时间 H2O2 | 0.1 g | 0.3 g | 0.8 g |
| 10 mL 1.5% | 223 s | 67 s | 56 s |
| 10 mL 3.0% | 308 s | 109 s | 98 s |
| 10 mL 4.5% | 395 s | 149 s | 116 s |
请回答下列问题:
(1)盛装双氧水的化学仪器名称是 。
(2)如何检验该套装置的气密性 。
(3)相同浓度的过氧化氢,其分解速率随着二氧化锰用量的增加而________。
(4)从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入________g的二氧化锰为较佳选择。
(5)某同学分析上述数据后认为:“当用相同质量的二氧化锰时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确________,理由是_______________________________________。(提示:H2O2的密度可认为近似相等)。
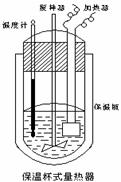 (Ⅱ)在如图所示的量热计中,将100mL 0.50mol·L-1CH3COOH溶
(Ⅱ)在如图所示的量热计中,将100mL 0.50mol·L-1CH3COOH溶
液与100mL0.55mol·L-1NaOH 溶液混合,温度从25.0℃升高到27.7℃。已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是
150.5J·℃-1生成溶液的比热容为4.184J·g-1·℃-1,溶液的密度均近似
为1g·mL-1。
(1)试求CH3COOH的中和热△H= 。
(2)CH3COOH的中和热的文献值为56.1KJ· mol-1,则请你分
析在(1)中测得的实验值偏差可能的原因 。
(3)实验中NaOH过量的目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与人类生产、生活、社会可持续发展密切相关,下列说法正确的是( )
A.“天宫”一号中使用的碳纤维,是一种新型有机高分子材料
B.为改善食品的色、香、味并防止变质,可加入大量食品添加剂
C.用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用
D.大量使用化肥和农药,以提高农作物产量
查看答案和解析>>
科目:高中化学 来源: 题型:
四氯化锡是无色液体,熔点-33"C,沸点114℃。氯气与金属锡在加热时反应可以用来制备SnCl4 ,SnCl4 极易水解,在潮湿的空气中发烟。实验室可以通过题1O图装置制备少量SnCl4 (夹持装置略)。
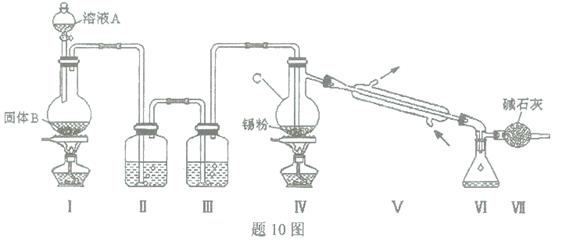
(1)仪器C的名称为 ;
(2)装置Ⅰ中发生反应的离子方程式为 ;
(3)装置Ⅱ中的最佳试剂为 ,装置Ⅶ的作用为 ;
(4)若装置连接顺序为Ⅰ—Ⅱ一Ⅳ一Ⅴ一Ⅵ一Ⅶ,在Ⅳ中除生成SnCl4 外,还会生成的含锡的化合物的化学式为 。
(5)Ⅳ中加热的作用之一是促进氯气与锡粉反应,加热的另一作用为 ;
(6)若Ⅳ中用去锡粉11.9 g,反应后,Ⅵ中锥形瓶里收集到23.8 g SnCl4 ,则SnCl4 的产率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
从海带中提取碘的实验过程中,涉及到下列操作,其中正确的是
| | |||
| A.将海带灼烧成灰 | B.过滤得含I-溶液 | C.萃取后放出碘 的CCl4溶液 | D.分离碘并回收CCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
根据以下3个热化学方程式
2H2S(g)+3O2(g)===2SO2(g)+2H2O(l) ΔH=-Q1 kJ·mol-1
2H2S(g)+O2(g)===2S(s)+2H2O(l) ΔH=-Q2 kJ·mol-1
2H2S(g)+O2(g)===2S(s)+2H2O(g) ΔH=-Q3kJ·mol-1
判断Q1、Q2、Q3三者关系正确的是( )
A.Q1>Q2>Q3 B.Q1>Q3>Q2 C.Q3>Q2>Q1 D.Q2>Q1>Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
我国卫星发射所用的长征2号火箭的主要燃料是偏二甲肼(C2H8N2),氧化剂是NO2,燃烧产物只有N2、CO2和H2O。有的国家用肼(N2H4)作为火箭发动机的燃料。NO2为氧化剂,反应生成N2和水蒸气。已知:
N2(g)+2O2(g)====2NO2(g) ΔH=+67.7 kJ·mol-1
N2H4(g)+O2(g)====N2(g)+2H2O(g) ΔH=-534 kJ·mol-1。
下列关于肼和NO2反应的热化学方程式中正确的是( )
A.2N2H4(g)+2NO2(g)====3N2(g)+4H2O (l) ΔH=+1 135.7 kJ·mol-1
B.2N2H4(g)+2NO2(g)====3N2(g)+4H2O(l) ΔH=-1 135.7 kJ·mol-1
C.N2H4(g)+NO2(g)====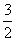 N2(g)+2H2O(g) ΔH=+1 135.7 kJ·mol-1
N2(g)+2H2O(g) ΔH=+1 135.7 kJ·mol-1
D.2N2H4(g)+2NO2(g)====3N2(g)+4H2O(g) ΔH=-1 135.7 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com