

���� ��1�����ݻ��ϼ۱仯����Ŀ��ϻ�ѧ����ʽ��ȷ������ת�Ƶ���Ŀ��
��2�������������ᶼ����Ư���ԣ�������������Ϊ���л�ɫ�ػ������ɲ��ȶ�����ɫ���ʶ�����Ư���ԣ���������Ϊ����ǿ�������ԣ��ܹ����л�ɫ�����������ȶ�����ɫ���ʶ�����Ư���ԣ��ݴ˽��
��3���������н�ǿ�������ԣ�����������н�ǿ�Ļ�ԭ�ԣ���ˮ��Һ�����߷�����ӦCl2+SO2+2H2O�T2HCl+H2SO4���ݴ˽��
��� �⣺��1��ʵ����װ��E���ö������̺�Ũ�����Ʊ�Cl2����Ӧ�Ļ�ѧ����ʽΪ��MnO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O����Ӧ��Mn���ϼ���+4�ۡ�+2�ۣ���ÿ��1molMnO2�μӷ�Ӧ������4mol�Ȼ��⣬����1mol������ת��2mol���ӣ�����6mol��HCl�μӷ�Ӧ����ת�Ƶĵ������ʵ���3mol��
�ʴ�Ϊ��MnO2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O��3mol��
��2�������������ᶼ����Ư���ԣ����Թ۲쵽B��D�����Թ��е�Ʒ����Һ���ֵ�������Ʒ����Һ��ɫ��
������������Ϊ���л�ɫ�ػ������ɲ��ȶ�����ɫ���ʶ�����Ư���ԣ���������Ϊ����ǿ�������ԣ��ܹ����л�ɫ�����������ȶ�����ɫ���ʶ�����Ư���ԣ�
���Լ��Ⱥ�B�Թ�������Ϊ����ɫ��Ʒ���ָֻ��ɺ�ɫ��D�Թ�����Ϊ������������
�ʴ�Ϊ��Ʒ����Һ��ɫ��Ʒ����Һ��ɫ����ɫ��Ʒ���ָֻ��ɺ�ɫ��
��3���������н�ǿ�������ԣ�����������н�ǿ�Ļ�ԭ�ԣ���ˮ��Һ������1��1������Ӧ�����ӷ���ʽ��Cl2+SO2+2H2O�T4H++2Cl-+SO42-�������ﶼ��Ư���ԣ����SO2��Cl2��1��1ͬʱͨ�뵽Ʒ����Һʱ��Ʒ����Һ������ɫ��
�ʴ�Ϊ��Cl2+SO2+2H2O�T4H++2Cl-+SO42-�������ﶼ��Ư���ԣ�
���� ���⿼�������Ʊ��Ͷ��������Ư�����ʣ���Ϥ�����Ͷ�������Ư��ԭ���IJ�ͬ�ǽ���ؼ�����Ŀ�Ѷ��еȣ�


 �����Ƹ���ʦ����ϵ�д�
�����Ƹ���ʦ����ϵ�д� ��ͨ����ͬ����ϰ��ϵ�д�
��ͨ����ͬ����ϰ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ���й��ڸ��л���������У�����ȷ���ǣ�������
���й��ڸ��л���������У�����ȷ���ǣ�������| A�� | ��������Ʒ�����Ӧ���ų����� | |
| B�� | ���ڴ�����������H2�����ӳɷ�Ӧ | |
| C�� | ��ʹ����KMnO4��Һ��ɫ | |
| D�� | ��ͭ�����������²����ܷ�����������Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ƽ��������Ӧ�����ƶ��� | B�� | ����B������������С�� | ||
| C�� | ����A��ת���ʼ����� | D�� | a��b |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | Zn���Ϸ�����ԭ��Ӧ | |
| B�� | ������Zn��a��b��Cu·������ | |
| C�� | Ƭ�̺��ҳ���c��Cu2+����С��c��SO42-���������䣬��Һ���ٱ��ֵ����� | |
| D�� | Ƭ�̺�ɹ۲쵽��ֽa����ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| N��N | H-H | N-H | |
| �������ݣ�KJ/mol�� | 946 | 436 | x |


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ԫ�����ڱ���λ�ڽ����ͷǽ����ֽ��߸�����Ԫ�����ڹ���Ԫ�� | |
| B�� | �����ԭ���У�����˽Ͻ����������˶��ĵ��������ϸ� | |
| C�� | P��S��Cl�õ�������������������Ӧˮ��������Ծ�������ǿ | |
| D�� | Ԫ��ԭ�ӵ���������������Ԫ�ص�����ϼ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ҵ��ķ���ʽ C2H5OH | B�� | �����ӵ�ʵ��ʽΪCH | ||
| C�� | ������ĵ���ʽ 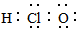 | D�� | ��ϩ�Ľṹ��ʽ CH2CH2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ױ�����������ԭ�Ӿ���ͬһ��ƽ���� | |
| B�� | ���ࡢ��֬�������������������¾��ɷ���ˮ�ⷴӦ | |
| C�� | ����ʽΪC3H8O���л�����Ũ���ᡢ���ȵ������·�Ӧ���ܵõ����л�������4�� | |
| D�� | �����������£�CH3CO18OC2H5��ˮ�������CH3CO18OH��C2H5OH |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com