
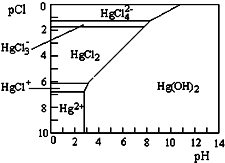
 水体中二价汞离子可以与多种阴离子结合成不同的存在形态.水溶液中二价汞主要存在形态与Cl-、OH-的浓度关系如图所示[注:粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-lgc(Cl-)],下列说法错误的是( )
水体中二价汞离子可以与多种阴离子结合成不同的存在形态.水溶液中二价汞主要存在形态与Cl-、OH-的浓度关系如图所示[注:粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-lgc(Cl-)],下列说法错误的是( )| A. | 正常海水(Cl-的浓度大于0.1mol•L-1)中汞元素的主要存在形态是HgCl42- | |
| B. | 少量Hg(NO3)2溶于0.001mol•L-1的盐酸后,汞元素的主要存在形态是HgCl2 | |
| C. | 将Hg(NO3)2固体直接溶于水中配制溶液 | |
| D. | 可用废铜屑处理含Hg2+的废水,其离子方程式为Cu+Hg2+═Cu2++Hg |
分析 A.据二价汞主要存在形态与Cl-、OH-的浓度关系图分析,在pCl=1时二价汞的主要存在形式;
B.据二价汞主要存在形态与Cl-、OH-的浓度关系图分析,在pCl=3时二价汞的主要存在形式;
C.Hg(NO3)2是强酸弱碱盐,在水溶液中能够水解,加酸可以抑制其水解;
D.铜比汞活泼,能够从汞的盐溶液中将汞置换出来.
解答 解:A.据二价汞主要存在形态与Cl-、OH-的浓度关系图分析,在pCl=1时二价汞的主要存在形式为:HgC142-、故A正确;
B.据二价汞主要存在形态与Cl-、OH-的浓度关系图分析,在pCl=1时二价汞的主要存在形式为HgC12,故B正确;
C.Hg(NO3)2是强酸弱碱盐,在水溶液中能够水解,水解的离子方程式为:Hg2++2H2O?Hg(OH)2+2H+,增大氢离子浓度,可以抑制其水解,所以配制硝酸汞溶液时,将硝酸汞溶液稀硝酸中,再加水稀释到所需浓度,故C错误;
D.铜比汞活泼,能够从汞的盐溶液中将汞置换出来,反应的离子方程式为:Cu+Hg2+?Cu2++Hg,故D正确;
故选C.
点评 本题考查了图象分析、盐类水解及水解平衡的移动、关于沉淀溶度积的计算,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 溴苯中的溴单质(NaOH溶液、分液) | B. | 硝基苯中的苯(蒸馏) | ||
| C. | 乙醇中的水(CaO、蒸馏) | D. | 乙烷中的乙烯(酸性高锰酸钾溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHB为强电解质 | B. | NaHB溶液中:c(Na+)<c(HB-)+2c(B2-) | ||
| C. | H2B为弱电解质 | D. | HB-的电离程度小于HB-的水解程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2和C(金刚石) | B. | CO2和H2 | C. | NaCl和HCl | D. | MgCl2和KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 将0.1mol•L-1Na2CO3溶液与0.1mol•L-1NaHCO3溶液等体积混合:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3) | |
| C. | 将0.1mol•L-1NH4Cl溶液与0.1mol•L-1氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| D. | 将0.1mol•L-1Na2C2O4溶液与0.1mol•L-1HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
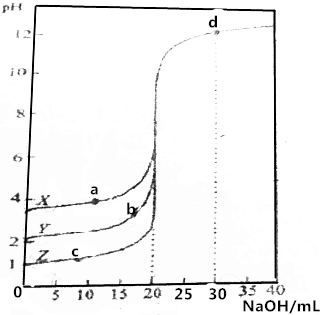 用0.1000mol•L-1的NaOH溶液分别滴定0.1000mol•L-1、20.00mLX、Y、Z三种酸溶液.溶液pH与加入NaOH体积之间的关系如图所示,下列说法错误的是( )
用0.1000mol•L-1的NaOH溶液分别滴定0.1000mol•L-1、20.00mLX、Y、Z三种酸溶液.溶液pH与加入NaOH体积之间的关系如图所示,下列说法错误的是( )| A. | Z为一元强酸 | |
| B. | d点的c(OH-)为0.02000mol•L-1 | |
| C. | a、b、c中b点的阴离子的物质的量浓度最大 | |
| D. | X、Y为一元弱酸,且其电离常数:Ka(x)<Ka(Y) |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com