
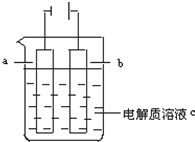
 如图所示:
如图所示:分析 (1)a与原电池的负极相连,b与原电池的正极相连;
(2)电解NaCl溶液时,阴极上氢离子得电子生成氢气,阳极上氯离子失电子生成氯气;
(3)电解精炼时,粗铜作阳极,Cu失电子生成铜离子,纯铜作阴极铜离子得电子生成Cu.
解答 解:(1)a与原电池的负极相连作电解池的阴极,b与原电池的正极相连作电解池的阳极;
故答案为:阴、阳;
(2)电解NaCl溶液时,阴极上氢离子得电子生成氢气,阳极上氯离子失电子生成氯气;
①a电极为阴极,阴极上氢离子得电子发生还原反应,生成氢气,其电极反应为2H++2e-=H2↑;
故答案为:2H++2e-=H2↑;还原;
②b电极为阳极,阳极上氯离子失电子发生氧化反应生成氯气,其电极反应为2Cl--2e-=Cl2↑;
故答案为:2Cl--2e-=Cl2↑;氧化;
(3)电解精炼时,粗铜作阳极,Cu失电子生成铜离子,纯铜作阴极铜离子得电子生成Cu;
①a电极为阴极,纯铜作阴极,铜离子得电子生成Cu,其电极反应式为:Cu2++2e-=Cu;
故答案为:纯铜;Cu2++2e-=Cu;
②b电极是阳极,粗铜阳极,粗铜失电子生成铜离子,其电极反应为Cu-2e-=Cu2+;
故答案为:粗铜;Cu-2e-=Cu2+.
点评 本题考查电解原理的应用,明确原理的原理、注意把握电极反应式的书写方法为解该题的关键,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 煤焦油干馏可得到苯、甲苯等 | |
| B. | 煤裂化可得到汽油、柴油、煤油等轻质油 | |
| C. | 石油分馏可得到乙烯、丙烯等重要化工产品 | |
| D. | 石油主要是各种烷烃、环烷烃和芳香烃组成的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.03mol | B. | 0.04mol | C. | 0.05mol | D. | 0.06mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3的水解:HCO3-+H2O?H3O++CO32- | |
| B. | 醋酸铵的电离:CH3COONH4?CH3COO-+NH4+ | |
| C. | H2的燃烧热为285.8kJ/mol:H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=-285.8kJ/mol | |
| D. | 碳在高温下还原二氧化硅 SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
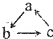 的转化关系(“→”表示在一定条件下可一步完成),下列各组物质中,不符合上述转化关系的是( )
的转化关系(“→”表示在一定条件下可一步完成),下列各组物质中,不符合上述转化关系的是( )| 选项 对应物质 | A | B | C | D |
| a | Cu(OH)2 | NO | Fe | Al |
| b | CuCl2 | NO2 | FeCl3 | Al(OH)3 |
| c | Cu | HNO3 | FeCl2 | AlO2- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | E1 | E2 | E3 | E4 |
| X | 522.05 | 7324.8 | 11856.6 | … |
| Y | 898.8 | 1763.58 | 14901.6 | 21084 |
| Z | 803.46 | 2436 | 3672.9 | 25116 |
| A. | X的原子电子层结构为1s22s1 | B. | Y为ⅡA族元素,其元素符号为Mg | ||
| C. | Z的价电子数为1 | D. | X的原子半径小于Y的原子半径 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
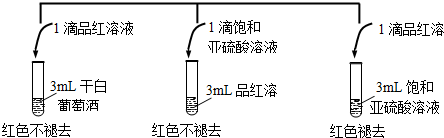
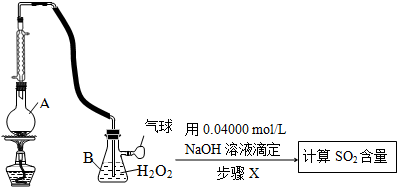
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
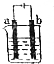 如图a、b均为铂电极,电解一段时间后,烧杯中溶液的pH增大,则选用的电解质溶液可以是( )
如图a、b均为铂电极,电解一段时间后,烧杯中溶液的pH增大,则选用的电解质溶液可以是( )| A. | H2SO4溶液 | B. | NaCl溶液 | C. | AgNO3溶液 | D. | KOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com