
| A. | Cl、S、P | B. | N、O、F | C. | Na+、Mg2+、Al3+ | D. | K、Na、Li |
分析 同周期自左而右原子半径减小,同主族自上而下原子半径增大,电子排布相同的离子,原子序数越大,离子半径越小,据此分析.
解答 解:A.P、S、Cl同周期,随原子序数增大原子半径减小,故原子半径Cl<S<P,故A正确;
B.N、O、F同周期,随原子序数增大原子半径减小,故原子半径N>O>F,故B错误;
C.Na+、Mg2+、Al3+同周期电子排布相同,随原子序数增大离子半径减小,故离子半径Na+>Mg2+>Al3+,故C错误;
D.K、Na、Li同主族,自上而下原子半径增大,故原子半径K>Na>Li,故D错误,
故选A.
点评 本题考查原子半径和离子半径的比较,比较基础,注意掌握同周期、同主族影响原子半径的因素,侧重于考查学生的分析能力和应用能力.


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
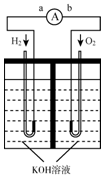 氢氧燃料电池是符合绿色化学理念的新型发电装置.下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学习小组的同学拟利用碘化亚铁与碳酸氢钠的反应来制备高纯度的碘化钠晶体.回答下列问题:
某学习小组的同学拟利用碘化亚铁与碳酸氢钠的反应来制备高纯度的碘化钠晶体.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 电极a和电极c都发生氧化反应 | |
| B. | 电极d的电极反应式为2H++2e-=H2↑ | |
| C. | 装置X中通入SO2的速率为2.24L•min-1(标准状况),为稳定持续生产,硫酸溶液的浓度应维持不变,则左侧水的流入速率应为1.16L•min-1 | |
| D. | 装置X中每消耗64g SO2,理论上装置X和装置Y中均有1mol H+通过质子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 序号 | 滴加试剂 | 0.1mol•L-1FeCl23mL | 0.1mol•L-1 FeCl3 mL |
| 1 | 滴入2滴KSCN溶液 | 溶液颜色无明显变化 | 溶液变为红色 |
| 2 | 滴入2滴苯酚溶液 | 溶液颜色无明显变化 | 溶液变为紫色 |
| 3 | 滴入2滴酸性的KMnO4溶液 | 溶液先变紫红后褪色 | 溶液变紫红色 |
| 4 | 滴入NaOH溶液 | 出现红棕色沉淀 |
| 试剂 | KSCN溶液3滴 | 苯酚溶液2滴 | 0.01mol•L-KMnO4溶液3滴 | 10%NaOH溶液10滴 |
| 0.1mol•L-1FeCl3 | 深红色 | 紫色 | 黄色 | 红褐色沉淀 |
| 0.1mol•L-1FeCl2 | 无色 | 无色 | 无色 | 灰绿色沉淀 |
| 0.01mol•L-1FeCl3 | 红棕色 | 无色 | 几乎无色 | 淡黄色 |
| 0.01mol•L-1FeCl2 | 无色 | 无色 | 无色 | 无色 |
| 0.001mol•L-1FeCl3 | 无色 | 无色 | 无色 | 无色 |
| 0.001mol•L-1FeCl2 | 无色 | 无色 | 无色 | 无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石英只能用于生产玻璃 | |
| B. | 从海水提取物质不一定要通过化学反应才能实现 | |
| C. | 二氧化硅能与氢氧化钠溶液反应,故常用氢氧化钠溶液作为雕刻玻璃的试剂 | |
| D. | 为了提高土壤肥力,往往将碳铵与熟石灰混合使用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com