
已知氨气和氯气混合可发生下列反应: 2NH3+3Cl2 → 6HCl+N2,NH3+HCl → NH4Cl。
常温常压下,取总物质的量为12mol的氯气和氨气的混合气体,完全反应后,气体总物质的量保持不变。做54、55题
反应前氯气和氨气的物质的量之比为______________ (要求解题过程)
反应后生成的氧化产物的质量为_________________(要求解题过程)
某天然碱(纯净物)可看作由CO2和NaOH反应后的产物所组成。称取天然碱样品四份,溶于水后,分别逐滴加入相同浓度的盐酸溶液30mL,产生CO2的体积(标准状况)如下表:
| Ⅰ | Ⅱ | Ⅲ | Ⅳ | |
| 盐酸液的体积(mL) | 30 | 30 | 30 | 30 |
| 样品(g) | 3.32 | 4.15 | 5.81 | 7.47 |
| 二氧化碳的体积(mL) | 672 | 840 | 896 | 672 |
由第Ⅰ组数据中的CO2体积与样品质量之比,可以推测用2.49g样品进行同样的实验时,产生CO2_________mL(标准状况)。(要求解题过程)
另取3.32g天然碱样品于300℃加热分解至完全(300℃时NaCO3不分解),产生CO2112mL(标准状况)和水0.45g,计算并确定该天然碱的化学式(要求解题过程)。
由上表中第Ⅳ组数据可以确定所用的HCl(aq)的浓度为 _______2.5
mol/L
科目:高中化学 来源: 题型:
500℃条件下,在恒容密闭容器中,充入1molNO2存在如下平衡2NO2(g) N2O4(g) ,平衡后,向容器内再充入1molNO2,下列说法正确的
N2O4(g) ,平衡后,向容器内再充入1molNO2,下列说法正确的
A.平衡向正反应方向移动 B.平衡常数K增大
C.NO2的转化率变小 D.容器内气体颜色先变深后变浅,最后比原来还要浅
查看答案和解析>>
科目:高中化学 来源: 题型:
 下表是元素周期表的一部分,有关说法不正确的是
下表是元素周期表的一部分,有关说法不正确的是
A.元素e的氧化物对应的水化物均为强酸
B.a、b、d、e四种元素的离子半径:
C.b、f两种元素形成的化合物为离子化合物
D.a、c、e的最高价氧化物对应的水化物之间能够相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g) ====N2(g)+CO2(g)+Q kJ·mol-1。
在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间(Min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①T1℃时,该反应的平衡常数K= ;
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)。
a.加入一定量的活性炭 b.通人一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则Q 0(填 “>”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,两个恒容密闭容器中分别发生下列两个反应:①H2(g)+I2(g) 2HI(g) ②C(s)+H2O(g)
2HI(g) ②C(s)+H2O(g) CO(g)+H2(g),下列状态能表明两反应都达到平衡状态的是
CO(g)+H2(g),下列状态能表明两反应都达到平衡状态的是
a. 各物质的浓度不变 b. 容器内气体压强不变
c. 容器内气体密度不变 d. 容器内气体颜色不变
e. 各组分的物质的量分数或质量分数不变
A. abc B. ade C. ae D. ac
查看答案和解析>>
科目:高中化学 来源: 题型:
肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,生成N2和水蒸气。已知:
N2(g)+2O2(g)=N2O4(g) ΔH=+8.7 kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534.0 kJ·mol-1
下列表示肼跟N2O4反应的热化学方程式,正确的是
A. 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-542.7 kJ·mol-1
B. 2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-1059.3 kJ·mol-1
C. N2H4(g)+ 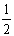 N2O4(g)=
N2O4(g)= N2(g)+2H2O(g) ΔH=-1076.7 kJ·mol-1
N2(g)+2H2O(g) ΔH=-1076.7 kJ·mol-1
D.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-1076.7 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
 下表是元素周期表的一部分,有关说法不正确的是
下表是元素周期表的一部分,有关说法不正确的是
A.元素e的氧化物对应的水化物均为强酸
B.a、b、d、e四种元素的离子半径:
C.b、f两种元素形成的化合物为离子化合物
D.a、c、e的最高价氧化物对应的水化物之间能够相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子一定能在指定环境中大量共存的是
A.在c(H+)=10-10 mol/L的溶液中: Al3+ 、NH 、Cl- 、NO
、Cl- 、NO
B.pH值为1的溶液: Fe3+、Na+ 、SO42-、HCO3—
C.水电离出来的c(H+)=10-12mol/L的溶液: K+、NH4+、Cl-、ClO-
D.pH值为13的溶液: K+ 、SO 、Na+、AlO2—
、Na+、AlO2—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com