


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
| A、氢键是一种特殊化学键,它广泛地存在于自然界中 |
| B、在CH3-CH-COOH分子中含有1个手性C原子 |
| C、碘单质在水溶液中溶解度很小是因为I2和H2O都是非极性分子 |
| D、含氧酸可用通式XOm(OH)n表示,若n值越大,则含氧酸的酸性越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 )中三个氢原子都可以跟重水(D2O)中氘原子发生交换,又知次磷酸(H3PO2)也能跟D2O进行氢交换,次磷酸钠(NaH2PO2)却不能再跟D2O发生氢交换,由此推断出次磷酸分子的结构是( )
)中三个氢原子都可以跟重水(D2O)中氘原子发生交换,又知次磷酸(H3PO2)也能跟D2O进行氢交换,次磷酸钠(NaH2PO2)却不能再跟D2O发生氢交换,由此推断出次磷酸分子的结构是( )A、 |
B、 |
C、 |
D、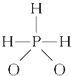 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓烟主要是由生成的大量NH4Cl造成的 |
| B、以上物质的水解都生成对应的酸和碱 |
| C、CCl4和SiCl4的分子结构相似,故CCl4也容易发生水解 |
| D、NH3属于弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
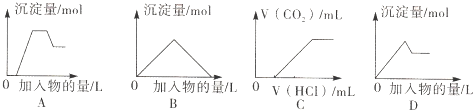
| A、图A表示向含H+、Mg2+、Al3+、NH4+的溶液中滴加NaOH溶液产生沉淀摄的关系曲线 |
| B、图B表示向澄清石灰水中通入二氧化碳直至过量产生沉淀量的关系曲线 |
| C、图C表示向NaOH和Na2CO3的混合液中滴加盐酸产生CO2气体的关系曲线 |
| D、图D表示向明矾溶液中滴加Ba(OH)2溶液产生沉淀最的关系曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操 作 | 现 象 | 结 论 | |
| (1) | 取少量该溶液于试管中, 滴加无色酚酞溶液 | 该溶液显碱性 | |
| (2) | 另取少量该溶液于试管中,滴加稀盐酸 | 有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N、M均不能发生银镜反应 |
| B、M中没有甲基 |
| C、M中含碳量为26.1% |
| D、N中含有甲基 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com