
【题目】铁镍蓄电池的工作原理为 。下列有关该电池的说法不正确的是( )
。下列有关该电池的说法不正确的是( )
A.电池放电时,正极为![]() ,负极为Fe
,负极为Fe
B.电池放电时,负极的电极反应为![]()
C.电池充电过程中,阴极附近溶液的pH降低
D.电池充电时,阳极![]() 被氧化为
被氧化为![]()
【答案】C
【解析】
根据电池反应可知,放电时,Fe失电子作负极,正极为Ni2O3,负极反应为:Fe+2OH--2e-=Fe(OH)2, 正极反应为:Ni2O3+3H2O+2e-=2Ni(OH)2+2OH-,据此解答。
A.由放电时的反应可以得出铁作还原剂失去电子,Ni2O3作氧化剂得到电子,即正极为Ni2O3、负极为Fe,A正确;
B.电池放电时,Fe在负极失电子生成Fe2+,由电池反应知最终生成Fe(OH)2,说明溶液呈碱性,负极反应为;Fe+2OH--2e-=Fe(OH)2,B正确;
C.充电过程中,阴极反应为Fe(OH)2= Fe+2OH--2e-,由于生成了OH-,溶液pH变大,C错误;
D.充电时阳极发生氧化反应,电极反应式为: 2Ni(OH)2+2OH-=Ni2O3+3H2O+2e-,Ni(OH)2被氧化为Ni2O3,D正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】(1)有下列化合物:甲 :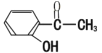 乙:
乙: ![]() 丙:
丙: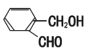 丁:
丁: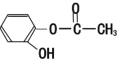
①请按酸性由强至弱排列甲、乙、丙的顺序:________(用甲乙丙表示)
②写出乙与乙醇发生酯化反应的化学方程式:____________。
(2)由丙烯下列反应可制得F、G两种高分子化合物,它们都是常用的塑料。
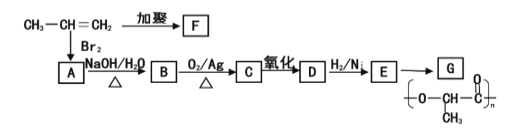
①写出E的结构简式:_______。
②C与新制的Cu (OH) 2 共热转化为D的化学力程式是:________。
③写出丙烯→F的化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电镀行业产生的酸性含铬废水对环境有污染,其中所含的Cr(Ⅵ)是主要污染物,可采用多种处理方法将其除去。查阅资料可知:
①在酸性环境下,Cr(Ⅵ)通常以Cr2O72-的形式存在;
②Cr2O72-的氧化能力强于CrO42-;
③常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
阳离子 | Fe3+ | Fe2+ | Cr3+ |
开始沉淀的pH | 1.9 | 7.0 | 4.3 |
沉淀完全的pH | 3.2 | 9.0 | 5.6 |
Ⅰ.腐蚀电池法
(1)向酸性含铬废水中投放废铁屑和焦炭,利用原电池原理还原Cr(Ⅵ)。下列关于焦炭的说法正确的是_______(填字母代号)。
a.作原电池的正极 b.在反应中作还原剂 c.表面可能有气泡产生
Ⅱ.电解还原法
向酸性含铬废水中加入适量NaCl固体,以Fe为电极电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准。电解装置如图1所示。
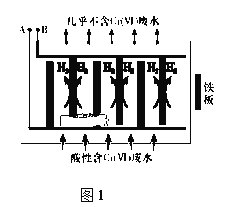
(2)A极连接电源的______________极,A极上发生的电极反应式为_______________
(3)电解开始时,B极上除了发生产生H2的反应外,还有少量Cr2O72-在B极上直接放电,该反应的电极反应式为_________________
(4)电解过程中,溶液的pH不同时,通电时间(t)与溶液中铬元素去除率的关系如图2所示。
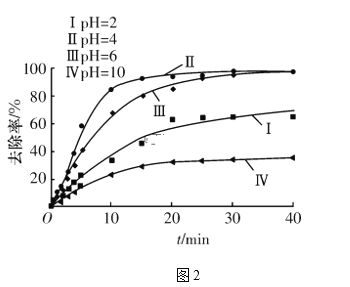
①由图可知,电解还原法应采取的最佳pH范围为____(填字母代号)。
a.2~4 b.4~6 c.6~10
②解释曲线Ⅰ和曲线Ⅳ去除率低的原因:________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种常见的非金属元素A与B,与常见的三种金属元素C、D、E,A的一种单质是自然界硬度最大的物质,B与C的单质在加热条件下反应生成淡黄色化合物X,D的单质既能与盐酸,也能与NaOH溶液反应生成![]() ,E的单质在B的单质中燃烧火星四溅,生成一种黑色固体Y。请回答下列问题:
,E的单质在B的单质中燃烧火星四溅,生成一种黑色固体Y。请回答下列问题:
![]() 物质X的名称______。
物质X的名称______。
![]() 将D的单质用砂纸打磨,然后灼烧,液态的D并不滴落的原因______。
将D的单质用砂纸打磨,然后灼烧,液态的D并不滴落的原因______。
![]() 写出E的单质与水蒸气反应的化学方程式______。
写出E的单质与水蒸气反应的化学方程式______。
![]() gC的单质投入足量
gC的单质投入足量![]() 溶液中,下列实验现象正确的有______。
溶液中,下列实验现象正确的有______。
A.钠沉在溶液底部
B.熔化成银色光亮的小球
C.小球四处游动发出”嘶嘶”的声音
D.生成红色固体物质
![]() 第
第![]() 中可能的离子方程式为______。将所得沉淀过滤、洗涤、干燥,可得到______g固体。
中可能的离子方程式为______。将所得沉淀过滤、洗涤、干燥,可得到______g固体。
![]() 在少量
在少量![]() 中燃烧,所得混合气体在标况下的平均摩尔质量为
中燃烧,所得混合气体在标况下的平均摩尔质量为![]() ,则A与
,则A与![]() 的物质的量之比为______。
的物质的量之比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是![]()
A.金属钠投入水中:![]()
B.往酸性碘化钾溶液中滴加适量的双氧水:![]()
C.往![]() 溶液中加过量的NaOH溶液并加热:
溶液中加过量的NaOH溶液并加热:![]()
![]()
![]()
D.氯气通入水中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,如下图是从该矿渣中回收NiSO4的工艺路线:
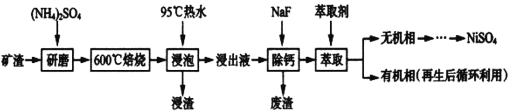
已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4,NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3。锡(Sn)位于第五周期第IVA族。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是_______________。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为_________________________,“浸渣”的成分除Fe2O3、FeO(OH)外还含有___________________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将:Fe3+还原为Fe2+,所需SnC12的物质的量不少于Fe3+物质的量的_____倍:除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为_________________________________________。
(4)“浸出液”中c(Ca2+)=1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-)=___mol· L-1。[已知KSP(CaF2)=4.0×10-11]
(5)已知正十二烷可用作该工艺的萃取剂。用电化学制备正十二烷的方法为:向烧杯中加入50mL甲醇,不断搅拌加入少量金属钠,再加入11mL正庚酸搅拌均匀,装好铂电极,接通电源反应,当电流明显减小时切断电源,然后提纯正十二烷。已知电解总反应为:2C6H13COONa+2CH3OH![]() C12H26+2CO2↑+H2↑+2CH3ONa,则阳极的电极反应式为______________________________________
C12H26+2CO2↑+H2↑+2CH3ONa,则阳极的电极反应式为______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积和pH都相同的盐酸和AlCl3溶液加水稀释时的pH变化曲线如图,下列有关说法正确的是( )
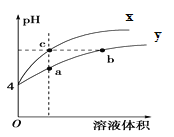
A.Al(OH)3的电离方程式为:Al(OH)3=Al3++3OH-
B.a点溶液中有: c(H+)+c(Al3+)=c(OH-) +3c(Cl-)
C.曲线X表示盐酸稀释过程的pH变化
D.b、c两溶液c(OH-)及c(Cl-)均相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释实验事实的方程式不正确的是( )
A.用Na2S处理含Hg2+的废水:Hg2++S2-=HgS↓
B.向沸水中滴加饱和氯化铁溶液得到红褐色液体:FeCl3+3H2O=Fe(OH)3(胶体)+3HCl
C.向Mg(OH)2悬浊液中滴加足量FeCl3溶液出现红褐色沉淀:3Mg(OH)2+2FeCl3=2Fe(OH)3+3MgCl2
D.Na2O2加入H218O中:2Na2O2+2H2l8O=4Na++4OH-+18O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下CH3COOH的电离常数K=1.6×10-5 mol·L-1。该温度下,向20mL0.01 mol·L-1CH3COOH溶液中逐滴加入0.01mol·L-1KOH溶液,其pH变化曲线如图所示(忽略温度变化)。
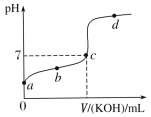
请回答下列有关问题:
(1)a、b、c、d四点中水的电离程度最大的是___点。
(2)若向20mL稀氨水中逐滴加入等浓度的盐酸,则下列变化趋势正确的是___填序号)。
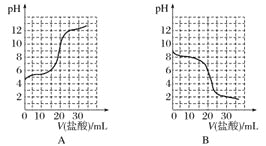
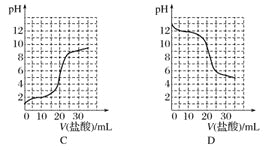
(3)把FeCl3溶液加热蒸干,灼烧,得固体物质为___(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com