
| Q | I1 | I2 | I3 | I4 | I5 | … |
| 电离能(kJ/mol) | 496 | 4562 | 6912 | 9543 | 13353 | … |
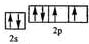 ,
, ;
; ,化合物HCN中C原子和N原子共用3对电子、H原子和C原子共用1对电子,所以HCN的结构式H-C≡N,
,化合物HCN中C原子和N原子共用3对电子、H原子和C原子共用1对电子,所以HCN的结构式H-C≡N, ;H-C≡N;
;H-C≡N;| 1 |
| 2 |
| 1 |
| 2 |


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验目的或结论 |
| A | 向CuSO4溶液中通入H2S气体,出现黑色沉淀 | H2S的酸性比H2SO4强 |
| B | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤 | 除去MgCl2溶液中少量FeCl3 |
| C | 蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再加入新制氢氧化铜悬浊液,水浴加热,未出现红色沉淀 | 蔗糖未水解 |
| D | C2H5OH与浓硫酸170℃共热,制得的气体通入酸性KMnO4溶液 | 检验制得气体是否为乙烯 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | |
| C | D |

| 化学式 | Ag2SO4 | AgBr |
| 溶解度(g) | 0.796 | 8.4×10-6 |
- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制前,用研钵把重铬酸钾研磨得越细越好 |
| B、把重铬酸钾粉末加到热水中,充分搅拌,使其溶解 |
| C、配制时,选用大容器的玻璃仪器(如 干燥器等) |
| D、在充分搅拌下把浓硫酸慢慢加入重铬酸钾溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 丙烯酰胺是一种重要的有机合成的中间体.它的球棍模型如图所示:(图中球与球之间连线表示单键或双键,不同颜色球表示不同原子:C、H、O、N)
丙烯酰胺是一种重要的有机合成的中间体.它的球棍模型如图所示:(图中球与球之间连线表示单键或双键,不同颜色球表示不同原子:C、H、O、N)| Ⅰ |
| Ⅱ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com