
利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3TiOSO4],生产硫酸亚铁和补血剂乳酸亚铁。其生产步骤如下:

请回答:
(1)步骤①中分离操作的名称是______;步骤⑥必须控制一定的真空度,原因是_________;
(2)废液中的TiOSO4在步骤①能水解生成滤渣(主要成分为TiO2?xH2O)的化学方程式为__________;步骤④的离子方程式为_____________________。
(3)用平衡移动原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因_______。
(4)配平酸性高锰酸钾溶液与硫酸亚铁溶液反应的离子方程式:_____Fe2++_____MnO4-+_____H+=_____Fe3++_____Mn2++_____
取步骤②所得晶体样品ag,溶于稀硫酸配成100.00 mL溶液,取出20. 00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol·L-1KMnO4溶液20.00mL,则所得晶体中FeSO4?7H2O的质量分数为(以含a的式子表示)_____________________。

【解析】
该题是目的是生成乳酸亚铁和硫酸亚铁.
(1)步骤①中得到滤渣和硫酸亚铁溶液,其操作是过滤。步骤⑥必须控制一定的真空度,其主要原因是,有利于水分的蒸发,以,防止Fe2+被氧化。
(2)由于是水解,必然水是反应物,另外已知了产物,TiO2?xH2O,根据守恒方知另一产物是硫酸。这样就可以写水解方程式TiOSO4+(x+1)H2O=TiO2?xH2O+H2SO4。
(3))FeCO3存在着溶解平衡,这样乳酸电离出的H+就会影响平衡向正方向移动;
(4)由化合价升降守恒,就可把方程式配平。由方程式找出Fe2+与MnO4-的计算计量数关系,方可进行计算:
W(FeSO4?7H2O=(0.10000mol/L×0.02L×5×5×278g/mol)÷ag=13.9/a


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014高考名师推荐化学氯、溴、碘及其化合物主要性质(解析版) 题型:选择题
用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是

A.若A为浓盐酸,B为KMnO4晶体,C中盛有紫色石蕊溶液,则C中溶液最终呈红色
B.实验仪器D可以起到防止溶液倒吸的作用
C.若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,则C中溶液先产生白色沉淀后沉淀又溶解
D.若A为浓H2SO4,B为Cu,C中盛有澄清石灰水,则C中溶液变浑浊
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学氧化还原概念(解析版) 题型:选择题
含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是
A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl-
B.x=0.6a,2Br-+Cl2=Br2+2Cl-
C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2++2Fe3++6Cl-
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学氧、硫及其化合物主要性质(解析版) 题型:选择题
下列说法正确的是
A.SO2和Cl2都能使品红溶液褪色,且加热后均恢复原色
B.SiO2是酸性氧化物,能与NaOH溶液反应
C.紫色石蕊试液滴入SO2水溶液中,先变红后褪色
D.向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,则该溶液中一定含有
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学氧、硫及其化合物主要性质(解析版) 题型:填空题
实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下:

(1)将过程②中产生的气体通入下列溶液中,溶液会褪色的是________。
A.品红溶液 B.紫色石蕊溶液
C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS和O2、H2SO4反应的化学方程式为______________________________
(3)过程③中,需加入的物质是________。
(4)过程④中,蒸发结晶需要使用酒精灯、三脚架、泥三角,还需要的仪器有________________。
(5)过程⑤调节pH可选用下列试剂中的________(填选项序号)。
A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70~80 ℃,目的是______________________。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学气体制备(解析版) 题型:选择题
现有NaCl、KSCN、NaOH、AgNO3四种溶液,只用一种试剂就能将它们鉴别开来,这种试剂是
A.盐酸 B.Na2CO3溶液
C.氯水 D.FeCl3溶液
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学有机推断(解析版) 题型:填空题
某有机物(分子式为C13H18O2)是一种食品香料,其合成路线如下图所示。

通过质谱法测得A的相对分子质量为56,它的核磁共振氢谱显示有两组峰且峰面积之比为1∶3;D分子中含有支链;F分子中含有苯环但无甲基,E可发生银镜反应在催化剂存在下1 mol E与2 mol H2可以发生反应生成F。请回答:
(1)B中所含官能团的名称为 ;E的结构简式为 。
(2)C与新制碱性Cu(OH)2悬浊液反应的离子方程式为
。
(3)D与F反应的化学方程式为 ;
其反应类型是 。
(4)符合下列条件:①遇FeCl3溶液显紫色;②苯环上有两个取代基的F的同分异构体有 种;写出其中一种物质的结构简式: 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学无机物性质及应用(非金属)(解析版) 题型:选择题
如A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产下图所示,物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。下列说法中不正确的是:
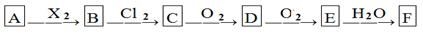
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.B和Cl2的反应是氧化还原反应
D.当X是强酸时,C在常温下是气态单质
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学弱电解电离(解析版) 题型:选择题
常温下,pH=12的氢氧化钠溶液pH=4的醋酸溶液等体积混合后恰好中和,忽略混合后溶液体积的变化,下列说法中正确的是
A.混合前的醋酸约1%发生电离
B.混合后的溶液中c(Na+)<c(CH3COO-)
C.氢氧化钠和醋酸和浓度不相等
D.混合后的溶液呈中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com