

分析 (1)由图可知,4min 时反应达到平衡状态,达到平衡时氨气增加0.10mol/L,根据v=$\frac{△c}{△t}$计算v(NH3);
(2)正反应为放热反应,升高温度平衡逆向移动,平衡常数减小;
(3)温度改变平衡一定发生移动,氨气的浓度一定变化,该反应为放热反应,升高温度平衡逆向移动,氨气浓度减小,降低温度平衡正向移动,氨气浓度增大,由于是可逆反应,不能完全转化应;
(4)体积减小,气体压强增大,平衡向气体体积减小的方向移动;
(5)第5分钟末将容器的体积缩小一半后,瞬间氨气的浓度变为原平衡的2倍,压强增大,平衡正向移动,氨气的浓度增大,在第8分钟末达到新的平衡时NH3的浓度约为0.25mol•L-1;
(6)A.增大压强平衡右移;
B.压强不同,平衡状态不同;
C.升高温度反应速率加快,平衡逆向移动;
D.催化剂不影响平衡移动.
解答 解:(1)由图可知,达到平衡时氨气增加0.10mol/L,v(NH3)=$\frac{0.1mol/L}{4min}$=0.025 mol•L-1•min-1,
故答案为:0.025;
(2)正反应为放热反应,升高温度平衡逆向移动,平衡常数减小,故答案为:减小;
(3)温度改变平衡一定发生移动,则NH3的物质的量浓度不可能为0.1mol/L,若升高温度,平衡逆向移动,氨气浓度减小,氨气不能完全转化,故0<c(NH3)<0.1mol/L,若降低温度,平衡正向移动,氨气浓度增大,由于是可逆反应,氮气不能完全转化应,则0.1mol/L<c(NH3)<0.2mol/L,故选:ac;
(4)该反应是气体体积减小的反应,把容器的体积缩小一半,增大了反应体系的压强,增大压强,平衡向气体体积减小的方向移动,即向正反应方向移动,故答案为:向正反应方向;
(5)第5分钟末将容器的体积缩小一半后,瞬间氨气浓度为0.40mol/L,压强增大,平衡正向移动,氨气的浓度增大,在第8分钟末达到新的平衡时NH3的浓度约为0.50mol•L-1,第5分钟末到平衡时NH3浓度的变化曲线图象为: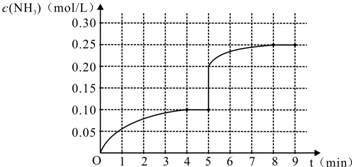 ,
,
故答案为: ;
;
(6)A.增大压强平衡右移,氨气的含量应增大,图象与实际不符,故A错误;
B.压强不同,平衡状态不同,不可能在同一平衡状态,图象与实际不符,故B错误;
C.升高温度平衡逆向移动,氨气的含量减小,图象与实际不符,故C错误;
D.催化剂不影响平衡移动,由图象可知1到达平衡时间过短,故催化剂性能1>2,故D正确.
故答案为:D.
点评 本题考查化学平衡的计算与影响因素、化学平衡图象、化学平衡的建立等,题目难度中等,(5)中作图注意缩小体积瞬间,氨气浓度变为原来的2倍.


科目:高中化学 来源: 题型:选择题
| A. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 | |
| B. | 氢氧化铁溶胶、水玻璃、淀粉溶液、PM2.5微粒均具有丁达尔效应 | |
| C. | 漂白粉在空气中久置变质 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 | |
| D. | 浓硫酸可刻蚀石英制艺术品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 化学反应方程式 | 已知条件 | 预测 |
| A | M(s)═X(g)+Y(s) | △H>0 | 它是非自发反应 |
| B | W(s)+xG(g)═20Q(g) | △H<0,自发反应 | x可能等于1、2、3 |
| C | 4X(g)+5Y(g)═4W(g)+6G(g) | 能自发反应 | △H一定小于0 |
| D | 4M(s)+N(g)+2W(l)═4Q(s) | 常温下,自发进行 | △H>0 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.4mol | B. | 2.4mol | C. | 3.8mol | D. | 5.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知某温度下:
已知某温度下: (g)?
(g)? (g)+H2(g),△H=+117.6kJ/mol.
(g)+H2(g),△H=+117.6kJ/mol. (g)?
(g)? (g)+CO(g)+H2O(g)△H=+158.8 kJ/mol.该反应的化学平衡常数K=K1•K2(用K1、K2表示).
(g)+CO(g)+H2O(g)△H=+158.8 kJ/mol.该反应的化学平衡常数K=K1•K2(用K1、K2表示).| T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
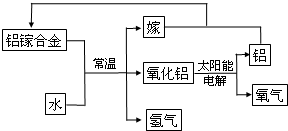 铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中.
铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现代生活离不开铝,铝有许多优良的性能,因此在各方面有极其广泛的用途.
现代生活离不开铝,铝有许多优良的性能,因此在各方面有极其广泛的用途.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com