
| HF | HClO | H2S | C6H5OH |
| Ki=3.53×l0-4 | Ki=2.95×l0-8 | K1=9.1×l0-8 K2=1.1×l0-12 | Ki=1.28×l0-10 |
| A. | ClO-+H2S→HClO+HS- | B. | H2S+2C6H5O-→2C6H5OH+S2- | ||
| C. | HF+C6H5O-→C6H5OH+F- | D. | HF(少量)+S2-→F-+HS- |
分析 弱酸电离常数越大,酸性越强,依据弱酸的电离平衡常数可知酸性强弱顺序:HF>HClO>H2S>C6H5OH>HS-,依据强酸制备弱酸规律解答.
解答 解:依据弱酸的电离平衡常数可知酸性强弱顺序:HF>HClO>H2S>C6H5OH>HS-,
A.次氯酸具有强的氧化性,能氧化硫化氢,故A错误;
B.C6H5OH>HS-,则H2S+C6H5O-→C6H5OH+HS-,故B错误;
C.氢氟酸酸性强于苯酚,所以HF+C6H5O-→C6H5OH+F-,故C正确;
D.氢氟酸强于硫化氢酸性,氢氟酸少量,反应生成氟离子和硫氢根离子,离子方程式:HF(少量)+S2-→F-+HS-,故D正确;
故选:CD.
点评 本题考查了离子方程式的书写,明确弱电解质电离常数与酸性强弱关系,熟悉强酸制备弱酸规律是解题关键,题目难度不大.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 可用水来鉴别苯和CCl4 | |
| B. | 煤的干馏属于化学变化,硝化反应、酯化反应、皂化反应都属于取代反应 | |
| C. | CH2Cl2有两种同分异构体 | |
| D. | 高温加热能杀死病毒是因为构成病毒的蛋白质受热变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 青蒿素可溶于乙醚和水 | |
| B. | 青蒿素的晶体为分子晶体,化学式为C16H20O5 | |
| C. | 青蒿素与NaOH溶液不反应 | |
| D. | 青蒿素含有过氧键,一定条件下有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
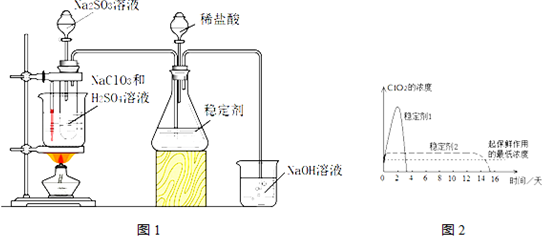
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
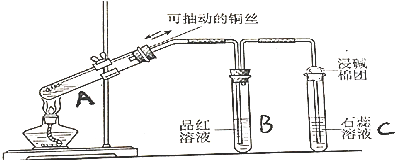
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一上10月月考化学试卷(解析版) 题型:推断题
甲、乙、丙均为化合物,其中甲为淡黄色的固体,乙常温下为无色无味液体,丙为常见的无色无味气体。它们有如下图的转化关系,已知D为黄绿色气体,按要求回答下列问题:

(1)甲物质为_____________(填化学式)。
(2)1mol乙和足量甲反应可生成______________mol B物质;1mol丙和足量甲反应可生成____________mol B物质。
(3)D能使湿润的有色布条褪色,其褪色原因是_______________。(结合化学反应方程式描述原因)
(4)丙与溶液F反应的化学方程式为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com