
【题目】肼(N2H4)是一种无色、易溶于水和具有强还原性的液体,沸点为113.5℃。广泛应用于医药等领域。工业上利用尿素法生产肼,同时得到副产品Na2CO3·10H2O,其工艺流程如下:
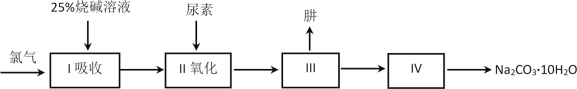
完成下列填空:
制肼过程的反应为:CO(NH2)2 + NaClO + 2NaOH → N2H4 + Na2CO3 + NaCl + H2O。
(1)将Cl2通入水中,所得溶液中具有氧化性的微粒是______________________。
(2)写出I吸收时发生反应的离子方程式__________________________。为保证后续反应充分,理论上需要通入氯气与烧碱溶液的质量之比应为71:____。
(3)已知氯酸钠有一定的氧化性。而在氯气和烧碱反应时,需控制反应温度防止氯酸钠生成。原因是______、____________。
(4)上述流程合成的Na2CO3·10H2O中含有杂质。若要检验杂质的阴离子,选择的试剂是________________________。
(5)Na2CO3·10H2O的纯度可用气体法测定,在一定温度和压强下,还需要测定的物理量___________________。
【答案】Cl2、HClO、ClO- Cl2 + 2OH—=ClO—+ Cl—+ 2H2O 640 次氯酸钠的氧化性强于氯酸钠 节省能源 稀硝酸、硝酸银溶液 反应前固体总质量、气体体积
【解析】
(1)氯气和水反应的方程式为:Cl2+H2O=HClO+HCl,氯水的成分:Cl2、HCl、H2O,H+、Cl﹣、ClO﹣、OH﹣,具有强氧化性的含氯元素的微粒为:Cl2、HClO、ClO﹣,故答案为Cl2、HClO、ClO﹣;
(2)由Cl2+H2O=HCl+HClO,可知Cl2与NaOH溶液发生反应时,氯气先与水反应,生成的盐酸、次氯酸再与氢氧化钠反应生成氯化钠、次氯酸钠和水,所以反应物是氯气和氢氧化钠,生成物是氯化钠、次氯酸钠和水,用观察法配平即可,所以方程式是:Cl2+2NaOH=NaCl+NaClO+H2O,离子方程式Cl2+2OH﹣=ClO﹣+Cl﹣+2H2O;根据氯气和氢氧化钠反应的方程式可知:投入的液氯与烧碱的质量之比为:35.5×2:2×40=71:80,再根据方程式:CO(NH2)2(尿素)+NaClO+2NaOH=N2H4+Na2CO3+NaCl+H2O,可知还需要氢氧化钠两份质量,所以液氯与烧碱的质量之比为71:160,则通入氯气与烧碱溶液的质量之比应为71:160/0.25=71:640;
(3)次氯酸钠的氧化性强于氯酸钠,温度高时生成氯酸钠,低温可节省能源,故答案为次氯酸钠的氧化性强于氯酸钠;节省能源;
(4)Na2CO310H2O中含有含有氯离子,实验室用硝酸酸化的硝酸银溶液检验氯离子,故答案为稀硝酸、硝酸银溶液;
(5)碳酸钠能与盐酸反应生成二氧化碳,根据二氧化碳的体积能确定碳酸钠的物质的量,然后可求出Na2CO310H2O的纯度,故答案为反应前固体总质量、气体体积。


科目:高中化学 来源: 题型:
【题目】芳香化合物A是一种基本化工原料,可以从煤和石油中得到。OPA是一种重要的有机化工中间体。A、B、C、D、E、F和OPA的转化关系如下所示:
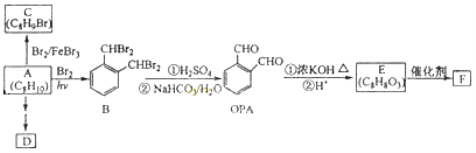
回答下列问题:
(1)A的化学名称是 ;
(2)由A生成B 的反应类型是 。在该反应的副产物中,与B互为同分异构体的化合物的结构简式为 ;
(3)写出C所有可能的结构简式 ;
(4)D(邻苯二甲酸二乙酯)是一种增塑剂。请用A、不超过两个碳的有机物及合适的无机试剂为原料,经两步反应合成D。用化学方程式表示合成路线 ;
(5)OPA的化学名称是 ,OPA经中间体E可合成一种聚酯类高分子化合物F,由E合成F的反应类型为 ,该反应的化学方程式为 。(提示![]() )
)
(6)芳香化合物G是E的同分异构体,G分子中含有醛基、酯基和醚基三种含氧官能团,写出G所有可能的结构简式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了日本吉野彰等三人,以表彰他们对锂离子电池研发的卓越贡献。
(1)自然界中主要的锂矿物为锂辉石、锂云母、透锂长石和磷锂铝石等。为鉴定某矿石中是否含有锂元素,可以采用焰色反应来进行鉴定,当观察到火焰呈________,可以认为存在锂元素。
A.紫红色 B.紫色 C.黄色
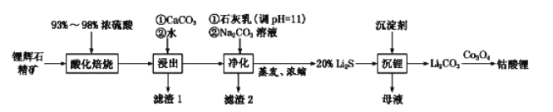
(2)工业中利用锂辉石(主要成分为LiAlSi2O6,还含有FeO、CaO、MgO等)制备钴酸锂(LiCoO2)的流程如下:
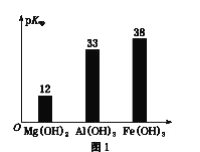
已知:部分金属氢氧化物的pKsp(pKsp=-lgKsp)的柱状图如图1。
回答下列问题:
①锂辉石的主要成分为LiAlSi2O6,其氧化物的形式为________。
②为提高“酸化焙烧”效率,常采取的措施是________。
③向“浸出液”中加入CaCO3,其目的是除去“酸化焙烧”中过量的硫酸,控制pH使Fe3+、A13+完全沉淀,则pH至少为_______。(已知:完全沉淀后离子浓度低于1×l0-5)mol/L)
④“沉锂”过程所获得的“母液”中仍含有大量的Li+,可将其加入到“___________”步骤中。
⑤Li2CO3与Co3O4在敞口容器中高温下焙烧生成钴酸锂的化学方程式为__________
(3)利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LiCoO2+C6 ![]() LixC6+Li1-xCoO2 ,其工作原理如图2。
LixC6+Li1-xCoO2 ,其工作原理如图2。
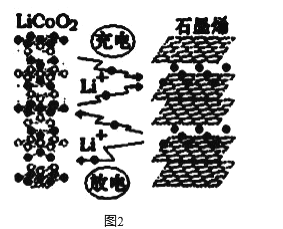
下列关于该电池的说法正确的是___________(填字母)。
A.电池反应式中过程1为放电过程
B.该电池若用隔膜可选用质子交换膜
C.石墨烯电池的优点是提高电池的储锂容量进而提高能量密度
D.充电时,LiCoO2 极发生的电极反应为LiCoO2-xe-=xLi++Li1-xCoO2
E.对废旧的该电池进行“放电处理”让Li+嵌入石墨烯中而有利于回收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
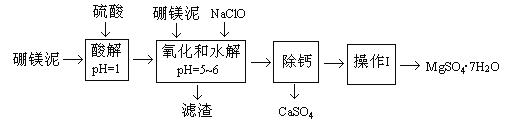
根据题意回答下列问题:
(1)实验中需用1mol/L的硫酸80mL,若用98%的浓硫酸来配制,除量筒、玻璃棒外,还需要的玻璃仪器有_________。
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有_________。
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式_________。在调节pH=5-6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为________________。
(4)如何检验滤液中Fe3+是否被除尽,简述检验方法_________。
(5)已知MgSO4、CaSO4的溶解度如下表:
温度(℃) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤_________、_________。
(6)如果提供的硼镁泥共100 g,得到的MgSO4·7H2O 196.8 g,则MgSO4·7H2O的产率为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。某学生拟用下图装置做草酸晶体的分解实验并验证部分产物,下列说法错误的是
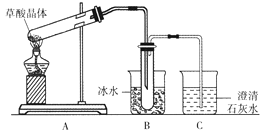
A. 装置A中的大试管口应略向下倾斜,是因为加热草酸晶体时会产生水
B. 装置B的主要作用是冷凝(水蒸气、草酸)等,防止草酸进入装置C中,干扰CO2的检验
C. 装置C中可观察到的现象是有气泡冒出,澄清石灰水变浑浊
D. 本实验能证明草酸晶体的分解产物有二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 滴入酚酞显红色的溶液:Na+、NH4+、NO3-、Cl-
B. 0.1mol·L-1Fe(NO3)2溶液:H+、Al3+、SO42-、Cl-
C. 0.1mol·L-1氨水溶液:K+、Na+、NO3-、A1O2-
D. c(H+)/c(OH-)=1012mol·L-1的溶液:Ca2+、NH4+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氟酸可用于半导体工业,也常用来蚀刻玻璃,其刻蚀反应原理如下:6HF+Na2SiO3→2NaF+SiF4↑+3H2O
完成下列填空:
(1)根据HF的___(选填编号)大于H2O,可推断氟元素的非金属性强于氧元素。
a.酸性 b.熔沸点 c.稳定性 d.键的极性
(2)SiF4与甲烷结构相似,SiF4是含___键的___分子(均选填“极性”或“非极性”)。刻蚀反应中的三种元素可组成同时含离子键和共价键的化合物,该化合物的电子式为___。
(3)Si原子核外电子有___种不同能量的电子,其中最高能量的电子处于___轨道。
(4)在相同条件下,Na2SiO3、CaSiO3分别与等浓度等体积的氢氟酸反应,两个反应原理相似,但前者的反应速率明显大于后者。原因是___。
(5)同浓度的H2SO3和HF两溶液的pH为:H2SO3___HF(选填“>”或“<”)。浓度均为0.01mol/L的H2SO3和HF的1L混合溶液中,通入0.02molNH3充分反应后,SO32-、HSO3-、F-、NH4+浓度从大到小的顺序为:___。
已知:H2SO3 Ki1=1.54×10-2 Ki2=1.02×10-7;HF Ki=6.8×10-4;NH3H2O Ki=1.8×10-5。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中的a和b为氢镍可充电碱性电池的电极,该电池总反应式为2Ni(OH)2![]() H2+2NiO(OH)。
H2+2NiO(OH)。
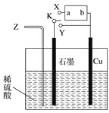
(1)为了实现铜与稀硫酸反应,用Z通入氧气的同时,将开关K与Y相连即可。石墨电极的反应式为______________________________,总反应的化学方程式为________________________________________;
(2)不通入氧气,直接将K与X相连也能实现铜与稀硫酸反应。则氢镍碱性电池的负极为________(填“a”或“b”),电解槽内总反应的离子方程式为_____________________________________________;
(3)当给氢镍碱性电池充电时,该电池的阳极反应式为__________________,氢镍电池放电时,负极附近的pH会________(填“变大”、“不变”或“变小”);
(4)若将图中的稀硫酸换成CuSO4溶液,并且将氢镍碱性电池的电极反接,将K连接X,通电一段时间后,向所得溶液中加入0.2 mol碱式碳酸铜[Cu2(OH)2CO3]后,恰好恢复到原来的浓度和pH(不考虑CO2的溶解),则电解过程中转移电子的物质的量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验课用KCl和NaNO3来制备KNO3的实验要用到减压过滤,下图是减压过滤的装置,请回答下列问题:

(1)写出图中A、B两种仪器的名称,
A_________________;B ___________________
(2)该装置图有几处错误,请指出B仪器处关键性的错误_____________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com