
【题目】A、B、C、D、E、F、G是七种常见的短周期元素,其原子序数依次增大,请根据所给信息填写表中空白,并回答下列问题:
编号 | 基本信息 | 解决的问题 |
① | 其中两种元素的原子核外电子层数与最外层电子数之比分别为 | 这两种元素分别是______(填元素符号,下同)、______. |
② | 其中一种元素的氧化物与强酸、强碱均能反应;另一种元素的单质、氧化物及氧化物对应的水化物均能与NaOH溶液反应 | 这两种元素分別是______、______. |
③ | G能与A、E分别形成原子个数比均为 | X的分子式为______, |
(1)仅由表中信息还不能确定的元素是______(填字母序号),若要确定其是何种元素,还需要的条件是______(填序号).
a.单质能与氧气反应
b.最高价氧化物对应的水化物是强酸
e.单质在常温下为固体
d.简单氯化物的稳定性比![]() 的简单氯化物强
的简单氯化物强
(2)基本信息②中,两种元素的氧化物分别与NaOH溶液反应的离子方程式为__________________,__________________.
(3)上述某两种元素间可形成原子个数比为![]() 及
及![]() 的两种能与水反应的常见化合物,写出前者与H2O反应的离子方程式:__________________.
的两种能与水反应的常见化合物,写出前者与H2O反应的离子方程式:__________________.
【答案】O Na Al Si CCl4 第三周期![]() 族 F b
族 F b 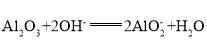
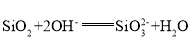
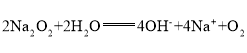
【解析】
短周期元素中电子层数与最外层电子数之比为![]() 的元素是氧,为
的元素是氧,为![]() 的元素是钠,短周期元素中氧化物与强酸、强碱均能反应的是
的元素是钠,短周期元素中氧化物与强酸、强碱均能反应的是![]() ,单质、氧化物及对应水化物均能与
,单质、氧化物及对应水化物均能与![]() 溶液反应的元素是
溶液反应的元素是![]() ,由③中化合物的原子个数比及原子序数关系可知,A是碳,E是硅,G是氯,进一步可推知D是铝,C是钠,B是氧,F是磷或硫,硫、磷单质在常温下均为固体,均能与氧气反应且简单氢化物的稳定性均比
,由③中化合物的原子个数比及原子序数关系可知,A是碳,E是硅,G是氯,进一步可推知D是铝,C是钠,B是氧,F是磷或硫,硫、磷单质在常温下均为固体,均能与氧气反应且简单氢化物的稳定性均比![]() 强,但硫的最高价氧化物对应的水化物是强酸而磷的不是;钠与氧能形成符合条件的两种常见化合物
强,但硫的最高价氧化物对应的水化物是强酸而磷的不是;钠与氧能形成符合条件的两种常见化合物![]() 、
、![]() ,据此回答。
,据此回答。
据上分析可知,A是碳,E是硅,G是氯,D是铝,C是钠,B是氧,;G能与A、E分别形成原子个数比均为![]() 的分子为CCl4、SiCl4;而Si核电荷数为14,有三个电子层,最外层电子数为4,因此其位于第三周期
的分子为CCl4、SiCl4;而Si核电荷数为14,有三个电子层,最外层电子数为4,因此其位于第三周期![]() 族;
族;
答案为:①O;Na ②Al;Si ③CCl4;第三周期![]() 族;
族;
(1)E、F、G原子序数依次增大,而E是硅,G是氯,所以F只能是磷或硫,仅由表中信息还不能确定的元素是F;硫、磷单质在常温下均为固体,均能与氧气反应且简单氢化物的稳定性均比![]() 强,但硫的最高价氧化物对应的水化物是强酸而磷的不是;因此若要确定还需要的条件是b;
强,但硫的最高价氧化物对应的水化物是强酸而磷的不是;因此若要确定还需要的条件是b;
答案为:F;b;
(2)基本信息②中,两种元素的氧化物分别氧化铝、二氧化硅,分别与NaOH溶液反应,离子方程式: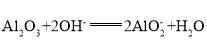 ,
,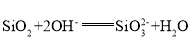 ;
;
答案为: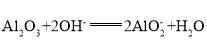 ,
, 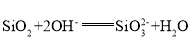 ;
;
(3)上述某两种元素间可形成原子个数比为![]() 及
及![]() 的两种能与水反应的常见化合物为
的两种能与水反应的常见化合物为![]() 、
、![]() ;
;![]() 与H2O反应的离子方程式:
与H2O反应的离子方程式: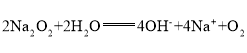 ;
;
答案为: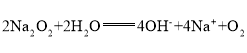 。
。


科目:高中化学 来源: 题型:
【题目】能正确解释下列反应原理,并且书写的离子方程式正确的是( )
A.用明矾作净水剂:Al3++3H2O=Al(OH)3↓+3H+
B.用小苏打治疗胃酸过多:CO32-+2H+=CO2↑+H2O
C.电解MgCl2饱和溶液制取Mg:MgCl2![]() Mg+Cl2↑
Mg+Cl2↑
D.用碳酸钠溶液浸泡锅炉水垢:CaSO4+CO32-=CaCO3+SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在同一碳原子上连有两个羟基的化合物是极不稳定的,它要自动失水生成含醛基的化合物。今在无其他氧化剂存在的条件下,以甲苯和氯气为主要原料按下列过程制取苯甲醛(C6H5CHO)。
![]()
(1)条件2中试剂为____________________________________________。
(2)写出苯甲醛与新制Cu(OH)2悬浊液反应的化学方程式:_________________________________________________________________。
(3)苯甲醛在强碱性条件下可发生自身氧化还原反应,即部分氧化成羧酸盐A,部分还原成醇B。写出A经酸化后的产物苯甲酸与B酯化反应可生成一种新的化合物C的结构简式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活及环境密切相关,下列有关说法不正确的是( )
A.餐具上的油污可用热的纯碱溶液清洗,纺织品上的油污不可以用烧碱溶液清洗
B.工业生产时加入适宜的催化剂,除了可以加快反应速率之外,还可以降低反应所需的温度,从而减少能耗
C.一定条件下,1mol 化合物X(![]() )最多可以与2molNaOH反应
)最多可以与2molNaOH反应
D.用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯以达到保鲜目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制取冰晶石(![]() )的化学方程式为
)的化学方程式为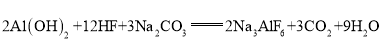 ,反应物中有两种元素在元素周期表中位置相邻,下列能判断它们的金属性或非金属性强弱的是( )
,反应物中有两种元素在元素周期表中位置相邻,下列能判断它们的金属性或非金属性强弱的是( )
A.简单氢化物的稳定性强弱
B.最高价氧化物对应水化物的碱性或酸性强弱
C.原子达到稳定结构失去或得到电子的多少
D.元素的最高化合价的高低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请用符号表示下列核素或同位素。
(1)质子数为![]() ,中子数为
,中子数为![]() 的
的![]() 原子:______。
原子:______。
(2)质子数和中子数都为9的氟原子:______。
(3)中子数为2的氢原子:______。
(4)中子数分别为8、9、10的氧原子:______。
(5)质量数分别为35、37的氯原子: ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】12.0g某液态有机化合物A完全燃烧后,生成14.4g H2O和26.4g CO2。测得有机化合物A的蒸气对H2的相对密度是30,求:
(1)有机物A的分子式_______________________。(写出计算过程)
(2)用如图所示装置测定有机物A的分子结构,实验数据如下(实验数据均已换算为标准状况):a mL(密度为ρ g/cm3)的有机物A与足量钠完全反应后,量筒液面读数为b mL,若1mol A分子中有x mol氢原子能跟金属钠反应,则x的计算式为____________(可以不化简,写出计算过程)。

(3)已知该有机物能够与金属钠或钾发生反应,并对有机物进行核磁共振操作,发现核磁共振氢谱图上有三组吸收峰,且峰面积之比为6:1:1,请写出该物质的结构简式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿烧渣(主要成分:Fe3O4、Fe2O3和FeO)得到绿矾(FeSO4·7H2O),再通过绿矾制备铁黄[FeO(OH)]的流程如下:烧渣![]() 溶液
溶液![]() 绿矾
绿矾![]() 铁黄
铁黄
已知:FeS2和铁黄均难溶于水。
下列说法不正确的是( )
A.步骤1,最好用硫酸来溶解烧渣
B.步骤2,涉及的离子方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+
C.步骤3,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾
D.步骤4,反应条件控制不当会使铁黄中混有Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个实验室制取氯气并以氯气为原料进行特定反应的装置:
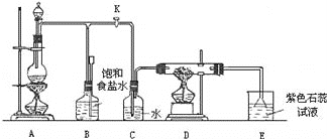
(1)A是氯气发生装置,其中反应的化学方程式为_____。
(2)实验开始时,先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处酒精灯,连接上E装置。Cl2通过C瓶后再进入D。D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为CO2和HCl。试写出D中反应的化学方程式:_____。装置C的作用是_____。
(3)在E处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是_____。
(4)若将E处烧杯中溶液改为澄清石灰水,反应过程现象为_____(选填标号)。
A.有白色沉淀生成 B.无现象 C.先生成白色沉淀,而后白色沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,此时B中的现象是_____,B的作用是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com