
分析 (1)CnH2n+1OH所表示的一元醇,有碳链异构和位置异构;
(2)能氧化成醛的醇的结构中必须含-CH2OH基团;
(3)当n<3时,此醇无同类的同分异构体,当n>3时,发生消去反应时,得到的消去产物的种类不一定相同,据此分析.
解答 解:(1)-CH3、-C2H5均只有1种,-C3H7有2种,故出现醇类同分异构体从n=3开始,有1-丙醇、2-丙醇之分,故答案为:3;
(2)n=4的同分异构体中,碳链异构有2种,而能氧化成醛的醇的结构中必须含-CH2OH基团,即必须-OH连在碳链的端点碳上,这样的醇有2种:CH3CH2CH2CH2OH,
(CH3)2CHCH2OH,故答案为:2,CH3CH2CH2CH2OH,(CH3)2CHCH2OH;
(3)3.当n>3时,醇发生消去反应所得的烯烃具有同分异构体,如n=4时,生成的烯烃有三种:CH3CH2CH=CH2、CH3CH=CHCH3和CH3CH2CH=CH2和(CH3)2CH=CH2,故要使此醇又具有同分异构体,消去反应后产物只有一种,则n的值应为3.故答案为:3.
点评 本题考查了有关醇的结构的推导,应注意的是能氧化成醛的醇的结构中必须含-CH2OH基团,即必须-OH连在碳链的端点碳上.


科目:高中化学 来源: 题型:选择题
| A. | 4△H3-6△H1-4△H2 | B. | 6△H1+4△H2-4△H3 | C. | △H1+△H2-△H3 | D. | △H3-△H1-△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
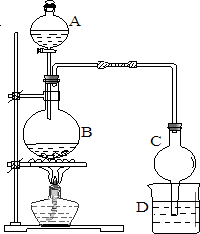 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、醋酸,D中放有饱和碳酸钠溶液.请回答:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、醋酸,D中放有饱和碳酸钠溶液.请回答: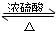 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
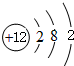 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +92.3 kJ•mol-1 | B. | -92.3 kJ•mol-1 | C. | -184.6 kJ•mol-1 | D. | +184.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4无论在水溶液或熔融状态下都可以电离出Na+、H+和SO42- | |
| B. | NaCl溶液能导电是因为溶液中有自由移动的Na+和Cl- | |
| C. | H2SO4在电流作用下在水中电离出H+和SO42- | |
| D. | 液态HCl,固态NaCl均不导电,所以HCl、NaCl都不是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌为负极,锌发生氧化反应 | |
| B. | 铜为正极,铜不易失去电子而受到保护 | |
| C. | 外电路电子流入的一极为正极电子流出的一极为负极 | |
| D. | 负极发生还原反应,正极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com