
 实验室中的CO2气体用大理石和稀盐酸反应制取,并用如图装置进行提纯和干燥.
实验室中的CO2气体用大理石和稀盐酸反应制取,并用如图装置进行提纯和干燥.分析 (1)配制一定体积比的溶液时,应选用烧杯、玻璃棒和量筒;
(2)碳酸氢钠溶液用于吸收HCl气体或吸收酸性气体;
(3)CO2气体可用中性和酸性物质干燥,干燥管内盛固体.
解答 解:(1)配制一定体积比的溶液时,应选用烧杯、玻璃棒和量筒,用量筒量出相同体积的浓盐酸和水,倒入烧杯中,用玻璃棒搅拌加速溶解,故答案为:abc;
(2)碳酸氢钠溶液用于吸收HCl气体或吸收酸性气体,故答案为:吸收HCl气体或吸收酸性气体;
(3)CO2气体可用中性和酸性物质干燥,干燥管内盛固体,故应为氯化钙,故答案为:b.
点评 本题考查了溶液的配制、气体的除杂、实验设计和评价等知识,题目难度中等,该题很好的将化学实验与其他化学知识有机地结合于一体,综合考查学生的能力和素质,考查知识也是从简单到复杂、从单一到综合,是一道质量结合的题目.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 向Na2CO3饱和溶液中,通入过量的CO2后,在减压、加热的条件下,蒸发得NaHCO3晶体 | |
| B. | 加热蒸发AlCl3饱和溶液得纯净的AlCl3晶体 | |
| C. | 向FeBr2溶液中加入过量的氯水,加热蒸发得FeCl3晶体 | |
| D. | 向FeCl3溶液里加入足量NaOH溶液,经过滤、洗涤沉淀,再充分灼烧沉淀得Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,其空间构型是直线形,由此可知它是非极性(填“极性”或“非极性”)分子.
,其空间构型是直线形,由此可知它是非极性(填“极性”或“非极性”)分子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 235U比239 Pu原子核内少4个中子 | |
| B. | 核反应堆中使用的重水与水互为同位素 | |
| C. | 石油、天然气等化石燃料属于可再生能源 | |
| D. | 合理使用核能可有效减少温室气体的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
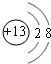 E在周期表中的位置第三周期第VIIA族
E在周期表中的位置第三周期第VIIA族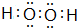
| 选项 | a | b | c | d |
| X | 温度 | 加入氢气 | 加入丙 | 温度 |
| Y | n(丙) | 丙的转化率 | n(生成物) | n(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若纯碱中混有K2CO3,盐酸用量将偏大;气体产量将偏大 | |
| B. | 若纯碱中混有NaHCO3,盐酸用量将偏大;气体产量将偏大 | |
| C. | 若纯碱中混有KHCO3,盐酸用量将偏小;气体产量将偏大 | |
| D. | 若纯碱中混有Na2SO3,盐酸用量将偏大;气体产量将偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铁片与氯化铜溶液反应:Fe+Cu2+═Cu+Fe3+ | |
| B. | 氯化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ | |
| C. | 碳酸钠溶液与盐酸反应:Na2CO3+2H+═2Na++CO2↑+H2O | |
| D. | NaHCO3溶液中加入过量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com