
 已知某可逆反应:mA(g)+nB(g)?pC(g)△H=Q kJ•mol-1,在密闭容器中进行,如图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确的是( )
已知某可逆反应:mA(g)+nB(g)?pC(g)△H=Q kJ•mol-1,在密闭容器中进行,如图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确的是( )| A. | T1<T2,P1>P2,m+n>p△Η<0 | B. | T1>T2,P1<P2,m+n<p△Η>0 | ||
| C. | T1<T2,P1>P2,m+n<p△Η<0 | D. | T1>T2,P1<P2,m+n>p△Η>0 |
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源:2016-2017学年陕西西藏民族学院附中高二上月考二化学卷(解析版) 题型:选择题
某金属能和盐酸反应生成氢气,与锌组成原电池时,锌为负极,则该金属可能为( )
A.铝 B.铜 C.锡 D.硅
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 装置 | 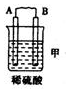 | 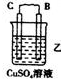 |  |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下列说法正确的是( )
下列说法正确的是( )| A. | FeO、Fe2O3和Fe3O4均为黑色固体 | |
| B. | 反应②③互为可逆反应 | |
| C. | 热稳定性顺序为:FeO>Fe2O3>Fe3O4 | |
| D. | 四氧化三铁中铁元素的化合价复杂,若写成氧化物的形式则化学式可写为FeO•Fe2O3,若视四氧化三铁为一种盐其化学式可写为Fe(FeO2)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑦⑧ | B. | ①③④⑦⑧ | C. | ②⑤⑥⑧⑨ | D. | ①④⑦⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2、HClO、SO2等物质都具有漂白作用 | |
| B. | 纯碱和小苏打都是碱 | |
| C. | 所有的置换反应都是氧化还原反应,而所有的复分解反应都是非氧化还原反应 | |
| D. | 非金属氧化物不一定是酸性氧化物,有些金属氧化物也能与强碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | -定条件下在密闭容器中2molSO2与2molO2充分反应,最终的气体分子数为3NA | |
| C. | 将1molNH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA | |
| D. | 已知C2H4(g)+H2(g)=C2H6(g)△H=-137.0kJ/mol,乙烯与H2加成时放出68.5kJ热量,则 反应过程中被破坏的碳碳双键的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测定HCl和NaOH中和反应的反应热时,单次实验均应测量3个温度,即盐酸起始温度、NaOH溶液起始温度和反应终止温度 | |
| B. | 若2C(s)+O2(g)=2CO(g)△H=-221.0kJ/mol,则碳的燃烧热为110.5KJ/mol | |
| C. | 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 | |
| D. | 已知I:反应H2(g)+Cl2(g)=2HCl(g);△H=-akJ/mol II:  且a、b、c均大于零,则断开1molH-Cl键所需的能量为2(a+b+c)kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com