
【题目】(1)在25 ℃、101 kPa的条件下,

请回答下列有关问题:
①由H+H→H2,当生成1 mol H2时,要________(填“吸收”或“放出”,下同)436 kJ的能量;由Cl2→Cl+Cl,当断裂1 mol Cl2中的共价键时,要________243 kJ的能量。
②对于反应H2(g)+Cl2(g)=2HCl(g),测得生成2 molHCl(g)时,反应过程中放出183 kJ的热量,则断开 1 mol H—Cl 键所需的能量是________kJ。
③有两个反应:a.H2(g)+Cl2(g)![]() 2HCl(g),b.H2(g)+Cl2(g)
2HCl(g),b.H2(g)+Cl2(g)![]() 2HCl(g)。这两个反应中,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量________(填“相等”或“不相等”)。
2HCl(g)。这两个反应中,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量________(填“相等”或“不相等”)。
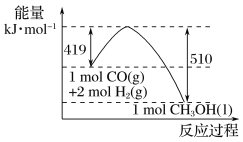
(2)根据图示的能量转化关系判断,生成16 g CH3OH(l)________(填“吸收”或“放出”)________kJ能量。
【答案】放出 吸收 431 相等 放出 45.5
【解析】
(1)①断开建吸收能量,成键需要释放能量;
②根据焓变=反应物总键能-生成物总键能;
③根据盖斯定律,反应热与反应条件无关,只与始态和终态有关;
(2)根据图示,反应物总能量高于生成物总能量,反应放出或吸收的能量与参与反应的物质的物质的量成正比。
(1)①断开建吸收能量,成键需要释放能量,由H+H→H2,是成键过程,释放能量,当生成1 mol H2时,要放出436 kJ的能量;由Cl2→Cl+Cl,是断键过程,断键吸收能量,当断裂1 mol Cl2中的共价键时,要吸收243 kJ的能量;
②根据焓变=反应物总键能-生成物总键能,断裂1molH-H键与1molCl-Cl键吸收的能量之和,即436kJ+243kJ=679kJ,设断开1molH-Cl键吸收的总能量为E(H-Cl),则有( 436kJ+243kJ) -2×E(H-Cl) =-183kJ,则E(H-Cl)=431kJ;
③两个反应的能量转化形式主要是化学能转化为热能,一个具体的反应释放能量的多少与反应条件无关,而与断开旧化学键和形成新化学键的能量变化有关,所以生成等量的产物所释放的能量相等;
(2)根据图示变化可知,反应物总能量高于生成物总能量,该反应属于释放能量的反应,生成1mol CH3OH(l)放出的能量为510kJ-419kJ=91kJ,16gCH3OH的物质的量为0.5mol,故生成16g CH3OH(l)放出的热量为45.5kJ。


科目:高中化学 来源: 题型:
【题目】下列模型分别表示C2H2、S8、SF6的结构,下列说法错误的是( )
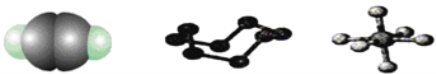
A. 32 g S8分子中含有0.125 mol σ键
B. SF6是由极性键构成的分子
C. 1 mol C2H2分子中有3 mol σ键和2 mol π键
D. S8中S的杂化方式为sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,按要求回答问题:
① |
| ||||||||||||||||
|
|
| ② | ③ | ④ |
|
| ||||||||||
⑤ | ⑥ |
|
|
|
|
|
|
|
|
|
| ⑦ |
|
| ⑧ | ⑨ |
|
(1)请写出下列元素的元素符号:①________③_________⑨___________。
(2)元素①④按2:1组成的化合物中化学键为_________。(填“共价键”或“离子键”)
(3)②的单质与⑧的最高价氧化物水化物热的浓溶液反应的化学方程式为____________。
(4)⑤⑥⑦的最高价氧化物水化物的碱性从大到小的顺序____________。(填化学式)
(5)④⑤⑥⑧形成的简单离子,其离子半径由小到大的顺序为____________(填离子符号)。
(6)④和⑧的氢化物稳定性从大到小的顺序为______________________。(填化学式)
(7)元素④的氢化物与⑤发生反应的方程式_____________,所得溶液PH____7(填“>”或“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微型纽扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应为Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-
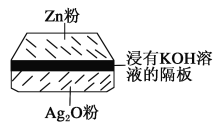
根据上述反应式,完成下列填空。
(1)下列叙述正确的是______。
A.在使用过程中,电解质溶液中的KOH被不断消耗,pH减小
B.使用过程中,电子由Ag2O极经外电路流向Zn极
C.Zn是负极,Ag2O是正极
D.Zn电极发生还原反应,Ag2O电极发生氧化反应
(2)写出电池的总反应式:___________。
(3)使用时,负极区的pH____(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,实验现象及结论都正确且两者具有因果关系的是
实验 | 现象 | 结论 | |
A | 向Ba(NO3)2溶液中通入二氧化硫气体 | 有白色沉淀生成 | SO2与Ba(NO3)2反应得到BaSO3 |
B | 向FeI2的溶液中滴加少量的氯水 | 溶液颜色变深 | Cl2与Fe2+反应生成Fe3+ |
C | 向蔗糖溶液中加几滴稀硫酸,水浴加热5min后,再加新制Cu(OH)2后加热 | 无砖红色沉淀生成 | 蔗糖没有水解 |
D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随![]() 的变化如图所示,下列叙述错误的是( )
的变化如图所示,下列叙述错误的是( )

A. MOH的碱性强于ROH的碱性
B. ROH的电离程度:b点大于a点
C. 若两溶液无限稀释,则它们的c(OH-)相等
D. 当![]() =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解结晶水合物CuCl·2H2O制备CuCl,并进行相关探究。
查阅资料:CuCl22H2O ![]() CuCl2
CuCl2 ![]() CuCl+Cl2;CuCl22H2O
CuCl+Cl2;CuCl22H2O![]() Cu2(OH)2Cl2
Cu2(OH)2Cl2![]() CuO
CuO
(实验探究)该小组用下图所示装置进行实验(夹持仪器略)。
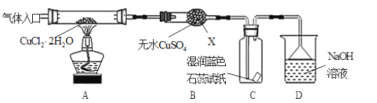
请回答下列问题:
(1)仪器X的名称是___;装置D中倒扣的三角漏斗的作用是_____;
(2)实验操作的先后顺序是a→____→____→____→e (填操作的编号)。
a.检查装置的气密性后加入药品 b.熄灭酒精灯,冷却 c.在“气体入口”处通入干燥HCl d.点燃酒精灯,加热 e.停止通入HCl,然后通入N2
(3)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是____;
(4)装置D中发生的氧化还原反应的离子方程式是_____;
(5)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息
①若杂质是CuCl2,则产生的原因是____;
②若杂质是CuO,则产生的原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二硫化钨(WS,WS2中W的化合价为+4)可用作润滑剂及石油化工领域中的催化剂。由钨铁矿(其主要成分是FeWO4,还含少量Al2()3)制备二硫化钨的工艺流程如图所示,下列说法正确的是
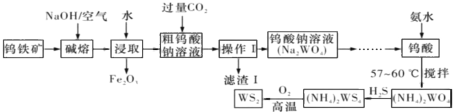
A.操作I中用到的玻璃仪器只有漏斗、烧杯
B.FeWO4在碱熔过程中发生反应的化学方程式为4FeWO4+O2+8NaOH![]() 2Fe2O3+4NaWO3+4H2O
2Fe2O3+4NaWO3+4H2O
C.生成二硫化钨的化学方程式为(NH4)2WS4+3O2![]() 2WS2+4NH3+2S2-+2SO2+2H2O,若生成124g WS2,则该反应所转移的电子数目为2NA
2WS2+4NH3+2S2-+2SO2+2H2O,若生成124g WS2,则该反应所转移的电子数目为2NA
D.滤渣I的主要成分是氢氧化铝,CO2可以用过量盐酸代替
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com