
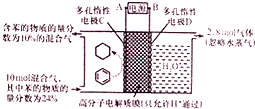
 一定条件,如图所示装置可实现有机物的电化学储氢(忽略其他有机物).下列说法中不正确的是( )
一定条件,如图所示装置可实现有机物的电化学储氢(忽略其他有机物).下列说法中不正确的是( )| A. | 导线中电子转移方向为C到A | |
| B. | 阳极生成2.8mol气体时,转移电子为11.2mol | |
| C. | 生成目标产物的电极反应式为C6H6+6H++6e-=C6H12 | |
| D. | 该储氢装置的电流效率η=64.3%(η=$\frac{生成目标产物消耗的电子数}{转移的电子总数}$×100%) |
分析 A、根据图知,苯中的碳得电子生成环己烷,则D作阴极,E作阳极,所以A是分解、B是正极,电子从负极流向正极;
B、根据阳极反应,结合阳极生成2.8mol气体时,来计算转移电子的量;
C、该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷;
D、阳极上生成氧气,同时生成氢离子,阴极上苯得电子和氢离子反应生成环己烷,苯参加反应需要电子的物质的量与总转移电子的物质的量之比就是电流效率η.
解答 额:A、根据图知,苯中的碳得电子生成环己烷,则D作阴极,E作阳极,所以A是分解、B是正极,电子从负极流向阴极,所以电子从A流向D,故A错误;
B、阳极上氢氧根离子放电生成氧气,阳极上生成2.8mol氧气,转移电子的物质的量=2.8mol×4=11.2mol,故B正确;
C、该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷,电极反应式为C6H6+6H++6e-=C6H12,故C正确;
D、阳极上氢氧根离子放电生成氧气,阳极上生成2.8mol氧气,转移电子的物质的量=2.8mol×4=11.2mol,生成1mol氧气时生成2mol氢气,则生成2.8mol氧气时同时生成5.6mol氢气,设参加反应的苯的物质的量是xmol,参加反应的氢气的物质的量是3xmol,剩余苯的物质的量为10mol×24%-xmol,反应后苯的含量$\frac{10mol×24%-x}{10mol-3xmol+5.6mol}$×100%=10%,x=1.2,苯转化为环己烷转移电子的物质的量为1.2mol×6=7.2mol,则 $\frac{7.2mol}{11.2mol}$×100%=64.3%,故D正确.
故选A.
点评 本题考查了化学平衡、电解池原理等知识点,根据化学平衡常数表达式、电解原理等知识点来分析解答,难点是D,注意:10mol×(24%-10%)不是参加反应的苯的物质的量,为易错点.


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:选择题
| A. | 150mL 2mol•L-1 KCl溶液 | B. | 75mL 0.5mol•L-1CaCl2溶液 | ||
| C. | 150mL 1mol•L-1 NaCl溶液 | D. | 75mL 1mol•L-1AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ①②③ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和碘水和CCl4加入分液漏斗中后,塞上上口部的塞子,用一手压住分液漏斗上口部,一手握住活塞部分,把分液漏斗倒转过来振荡 | |
| B. | 静置,待分液漏斗中液体分层后,先使分液漏斗内外空气相通(准备放出液体) | |
| C. | 打开分液漏斗的活塞,使全部下层液体沿承接液体的烧杯内壁慢慢流出 | |
| D. | 最后继续打开活塞,另用容器承接并保存上层液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 H]-
H]-

| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
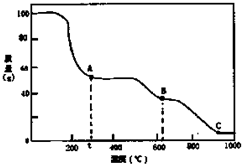
| A. | 0℃→t℃的过程变化是物理变化 | |
| B. | C点物质是工业上冶炼铝的原料 | |
| C. | A→B反应中生成物只有Al2(SO4)3和NH3两种 | |
| D. | Al2(SO4)3能够净水,其原理为:Al3++3OH?Al(OH)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com