
. 已知外电路中,电子由铜流向a极。有关下图所示的装置分析合理的一项是

A.该装置中Cu极为正极
B.当铜极的质量变化为12 .8g时,a极上消耗的O2在标准状况下的体积为2.24L
C.b极反应的电极反应式为:H2-2e-=2H+
D.一段时间后锌片质量减少
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:
(08济南二月统考,15)“神舟六号”宇宙飞船的能量部分来自太阳能电池,另外内部还配有高效的MCFC型燃料电池。该电池可同时供应电和水蒸气,所用燃料为氢气,电解质为熔融的碳酸钾。已知该电池的总反应为2H2+O2 === 2H2O,负极反应为H2+CO2—3→CO2↑+H2O+2e—,则下列推断中,正确的是( )
A.电池工作时,CO2—3向负极移动
B.电池放电时,外电路电子由通氧气的正极流向通氢气的负极
C.正极的电极反应为:4OH—→O2↑+2H2O+2e—
D.通氧气的电极为阳极,发生氧化反应
查看答案和解析>>
科目:高中化学 来源:2012届江苏省南通市通州区高三4月查漏补缺专项检测化学试卷(带解析) 题型:填空题
(14分)三氧化二镍是一种重要的电子元件材料、蓄电池材料。工业上利用含镍废料(镍铁钙镁合金为主)制取草酸镍,再高温煅烧草酸镍制取三氧化二镍。已知草酸的钙、镁、镍盐难溶于水。根据下列工艺流程示意图回答问题。
(1)生产过程中多次进行过滤。实验室进行过滤操作中用到玻璃棒,玻璃棒的作用是 。
(2)加入过氧化氢后缓慢加入碳酸钠溶液调pH至4.0~4.5左右,加入碳酸钠溶液的作用是 。再加入NH4F的目的是 。
(3)草酸镍(NiC2O4·2H2O)在热空气中干燥脱水后在高温下煅烧三小时,制得三氧化二镍,同时获得一种混合气体。写出草酸镍受热分解的化学方程式 。
(4)工业上还可用电解法制取三氧化二镍。用NaOH溶液调节NiCl2溶液pH至7.5,加入适量硫酸钠后采用惰性电极进行电解。电解过程中产生的Cl2有80%在弱碱性条件下生成ClO-,再把二价镍氧化为三价镍。写出ClO-氧化Ni(OH)2生成三氧化二镍的离子方程式 。a mol二价镍全部转化为三价镍时,外电路中通过电子的物质的量是 。
(5)电解法制取三氧化二镍实际过程中,有时获得一种结晶水合物,已知1mol该物质中含有0.5 mol结晶水。取该化合物20.2 g进行充分加热,而获得三氧化二镍固体和0.2 mol水,则该结晶水合物的化学式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市海淀区高三上学期期末考试化学试卷(解析版) 题型:填空题
人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。
(1)工业上常用高浓度的K2CO3 溶液吸收CO2,得溶液X,再利用电解法使K2CO3 溶液再生,其装置示意图如下:

在阳极区发生的反应包括 和H ++ HCO3-=H2O+CO2↑。
简述CO32-在阴极区再生的原理 。
(2)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。
已知:25 ℃,101 KPa下:
H2(g)+1/2 O2(g)=H2O(g) Δ H1= -242 kJ/mol
CH3OH(g)+3/2 O2(g)=CO2 (g)+2 H2O(g) Δ H2= -676 kJ/mol
写出CO2和H2生成气态甲醇等产物的热化学方程式 。
下面表示合成甲醇的反应的能量变化示意图,其中正确的是 (填字母序号)。
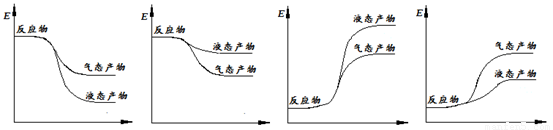
a b c d
(3)微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置。已知某种甲醇
微生物燃料电池中,电解质溶液为酸性,示意图如下:

该电池外电路电子的流动方向为 (填写“从A到B”或“从B到A”)。
工作结束后,B电极室溶液的pH与工作前相比将 (填写“增大”、“减小”或“不变”,溶液体积变化忽略不计)。
A电极附近甲醇发生的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年山东省高三上学期第三次质量检测化学试卷 题型:选择题
“神舟七号”宇宙飞船的能量部分来自太阳能电池,另外内部还配有高效的MCFC型燃料电池。该电池可同时供应电和水蒸气,所用燃料为氢气,电解质为熔融的碳酸钾。已知该电池的总反应为2H2+O2 =2H2O,负极反应为H2 + CO32—→CO2↑ + H2O + 2e—,则下列推断中,正确的是
A.电池工作时,CO32—向负极移动
B.电池放电时,外电路电子由通氧气的正极流向通氢气的负极
C.正极的电极反应为:4OH—→O2↑+2H2O+2e—
D.通氧气的电极为阳极,发生氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com