
| A. | 氯化钠和泥沙 | B. | 汽油和柴油 | C. | 四氯化碳和水 | D. | 氯化钙和硫酸钡 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
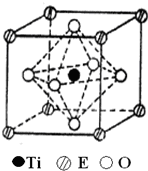 A、B、C、D、E五种元素都是前36号元素,原子序数依次增大,其相关信息如下表:
A、B、C、D、E五种元素都是前36号元素,原子序数依次增大,其相关信息如下表:| 元素 | 相关信息 |
| A | A的第一电离能低于同周期左右相邻元素 |
| B | B原子中成对电子数等于未成对电子数的2倍 |
| C | C原子p轨道和s轨道中的电子数相等,与非金属的原子结合时形成共价键 |
| D | D与A、B、C均不同周期,其一个单质分子中只有一个σ键 |
| E | E的原子序数比所处周期中未成对电子数最多的元素大3 |
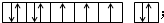 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
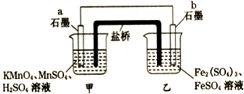
| A. | b电极上发生的反应:Fe2+-e-═Fe3+ | |
| B. | a电极上发生氧化反应:MnO4-+8H++5e-═Mn2++4H2O | |
| C. | 外电路电子的流向是从a到b | |
| D. | 电池工作时,盐桥中的SO42-移向甲烧杯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CN-和N2 | B. | NO和O2 | C. | NO2和CO2 | D. | SO2和ClO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C原子采取sp3杂化,O原子采取sp杂化 | |
| B. | 甲醛分子中中心原子价层电子对数为4,含有一对孤电子对,是三角锥形结构 | |
| C. | 甲醛分子与水分子间可以形成氢键 | |
| D. | 甲醛分子为非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取11.72g食盐 | |
| B. | 用100mL的量筒量取25.00mL盐酸 | |
| C. | 用pH试纸测得某稀醋酸溶液的pH为3.5 | |
| D. | 用0.2000mol•L-1HCl溶液滴定20.00mL未知浓度NaOH,用去22.40mL HCl溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com