
| A. | Na2CO3和NaHCO3均能与盐酸和NaOH溶液反应 | |
| B. | NaHCO3固体中混有的Na2CO3可用加热的方法除去 | |
| C. | Na2O2和Na2O中阴阳离子个数比均为1:2 | |
| D. | 分别向Na2O2和Na2O与水反应后的溶液中立即滴入酚酞溶液,现象相同 |
分析 A、碳酸钠与氢氧化钠不反应,而碳酸氢钠既与盐酸反应也与氢氧化钠反应;
B、NaHCO3不稳定,加热易分解;
C、Na2O是由钠离子和氧离子构成的离子化合物,Na202是由钠离子和过氧根离子构成的离子化合物;
D、根据氧化钠和过氧化钠和水反应的产物来回答.
解答 解:A、碳酸钠与氢氧化钠不反应,而碳酸氢钠既与盐酸反应也与氢氧化钠反应,而NaHCO3均能与盐酸和NaOH溶液反应,故A错误;
B、NaHCO3不稳定,加热易分解:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,碳酸钠受热不易分解,较稳定,除去碳酸氢钠固体中混有的少量碳酸钠,不能用加热的方法,否则导致碳酸氢钠变质,故B错误;
C、Na2O是由钠离子和氧离子构成的离子化合物,电子式为 ,所以阴阳离子个数比是1:2,Na202是由钠离子和过氧根离子构成的离子化合物,电子式为
,所以阴阳离子个数比是1:2,Na202是由钠离子和过氧根离子构成的离子化合物,电子式为 ,阴阳离子个数比是1:2,故C正确;
,阴阳离子个数比是1:2,故C正确;
D、氧化钠和水反应生成氢氧化钠,无气泡产生,过氧化钠和水反应生成氢氧化钠和氧气,产生气泡,而此时溶液中溶有大量游离的氧,所以当立即滴加酚酞溶液都变红后迅速褪色,现象不同,故D错误.
故选C.
点评 本题考查钠的氧化物,明确发生的化学反应及相关的概念是解答本题的关键,难度不大.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K 越大,反应物的转化率越小 | B. | K 与温度一定有关 | ||
| C. | K 与生成物的浓度一定有关 | D. | K 与反应物的浓度一定有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
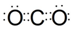 ;该化合物熔沸点低于CS2的原因是两者都为分子晶体,且结构相似,CS2式量大于CO2,CS2范德华力大,故CS2熔沸点高于CO2.
;该化合物熔沸点低于CS2的原因是两者都为分子晶体,且结构相似,CS2式量大于CO2,CS2范德华力大,故CS2熔沸点高于CO2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200 mL 1 mol•L-1 KCl溶液 | B. | 50 mL 2 mol•L-1CaCl2溶液 | ||
| C. | 150 mL 2 mol•L-1 NaCl溶液 | D. | 50 mL 1 mol•L-1AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:下表为25℃时某些弱酸的电离平衡常数.
已知:下表为25℃时某些弱酸的电离平衡常数.| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7Ka2=4.7×10-11 |
| A. | 25℃时,相同浓度的NaHCO3溶液的碱性大于NaClO溶液 | |
| B. | 图象中a点的导电能力小于c点 | |
| C. | 图象 I代表CH3COOH溶液的稀释 | |
| D. | 图象中a点酸的总浓度大于b点酸的总浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 依据图甲可判断正反应为吸热反应 | |
| B. | 在图乙中,虚线可表示压强增大 | |
| C. | 若正反应的△H<0,图丙可表示升高温度使平衡向逆反应方向移动 | |
| D. | 由图丁中气体平均相对分子质量随温度的变化情况,可推知正反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 有12mol(NH4)2SO4分解 | B. | 有6mol原子被还原 | ||
| C. | 生成2mol氧化产物 | D. | 生成7molH2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com