
【题目】原电池是化学对人类的一项重大贡献。
Ⅰ(1).某兴趣小组为研究原电池原理,设计如图装置。a和b不连接时,烧杯中发生反应的现象是___________________________。反应的离子方程式为__________________。
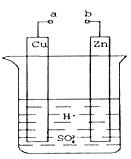
(2).a和b用导线连接,Cu极为原电池_____(填“正”或“负”)极,电极反应式是__________,发生__________(填“氧化”或“还原”)反应。
Ⅱ(3).有同学想把Ba(OH)28H2O晶体与NH4Cl晶体的反应设计成原电池,你认为是否可行?________(填“是”或“否”)。
(4).将a与直流电源的正极相连并把Cu换成石墨电极,b与直流电源的负极相连,则石墨电极为_________极(填“阳”或“阴”)发生__________(填“氧化”或“还原”)反应,溶液中H+移向_____(填“C”或“Zn”)极。该过程的总反应方程式为_______________________。
【答案】锌片逐渐溶解并有气泡产生 Zn+2H+=Zn2++H2↑ 正 2H++2e-=H2↑ 还原 否 阳 氧化 Zn 2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
【解析】
Ⅰ⑴a和b不连接时,是锌和硫酸反应,锌不断溶解,产生气泡,其离子反应是Zn+2H+=Zn2++H2↑;
⑵a和b用导线连接,Zn是活泼金属,作负极,发生氧化反应,Cu是较活泼金属,作正极,发生还原反应,电极反应式是2H++2e-=H2↑;
Ⅱ⑶设计原电池必须是自发的放热的氧化还原反应,Ba(OH)28H2O晶体与NH4Cl晶体是非氧化还原反应,因此不能设计成原电池;
⑷连接电源正极的为阳极,因此石墨电极为阳极,发生氧化反应,溶液中离子遵循“异性相吸”,因此H+移向阴极即Zn极;该过程是电解水的过程,其总反应方程式为2H2O![]() 2H2↑+O2↑。
2H2↑+O2↑。


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】某化学研究小组探究外界条件对化学反应mA(g)+n(B)(g) ![]() pC(g)的速率和平衡的影响图像如下,下列判断正确的是( )
pC(g)的速率和平衡的影响图像如下,下列判断正确的是( )
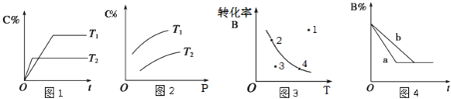
A.由图1可知,T1<T2,该反应正反应为吸热反应
B.由图2可知,该反应m+n<p
C.图3中,表示反应速率v(正)>v(逆)的是点3
D.图4中,若m+n=p,则a曲线一定使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是![]()
![]() 明矾可用于水的消毒净化;碳酸钡不可用于钡餐透视
明矾可用于水的消毒净化;碳酸钡不可用于钡餐透视
![]() 氮氧化物和碳氢化合物是构成光化学烟雾的重要物质
氮氧化物和碳氢化合物是构成光化学烟雾的重要物质
![]() 氨常用作制冷剂,是因为其沸点极低,很容易液化
氨常用作制冷剂,是因为其沸点极低,很容易液化
![]() 硅的提纯与应用,促进了半导体元件与集成芯片的发展,可以说“硅是信息技术革命的催化剂”
硅的提纯与应用,促进了半导体元件与集成芯片的发展,可以说“硅是信息技术革命的催化剂”
(5)SiCl4在战争中常用作烟雾弹,是因为它水解时生成白色烟雾
![]() 通电时,溶液中溶质粒子分别向两极移动,胶体中胶粒向某一极移动
通电时,溶液中溶质粒子分别向两极移动,胶体中胶粒向某一极移动
![]() 铝粉和氧化镁粉末混合,高温能发生铝热反应
铝粉和氧化镁粉末混合,高温能发生铝热反应
![]() 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遭遇强碱会“断路”
高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遭遇强碱会“断路”
![]() 可用稀盐酸、碳酸钠溶液、硅酸钠溶液设计实验来验证元素的非金属性
可用稀盐酸、碳酸钠溶液、硅酸钠溶液设计实验来验证元素的非金属性
![]() 同主族元素的简单阴离子还原性越强,水解程度越大
同主族元素的简单阴离子还原性越强,水解程度越大
(11)Al2O3在工业上用于制作耐高温材料,也用于电解法治炼铝.
A.3句B.4句C.5句D.6句
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素周期表中共有18个纵行,下图实线表示元素周期表的边界。按核外电子排布,可把元素周期表里的元素划分为![]() 区、
区、![]() 区、
区、![]() 区、
区、![]() 区等。除
区等。除![]() 区外,其他区的名称来自按构造原理最后填入电子的能级的符号。
区外,其他区的名称来自按构造原理最后填入电子的能级的符号。
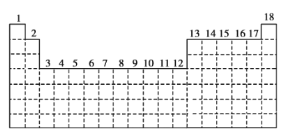
(1)请在上图中用实线画出![]() 区、
区、![]() 区、
区、![]() 区、
区、![]() 区的边界线,并分别用阴影
区的边界线,并分别用阴影![]() 和
和![]() 表示
表示![]() 区和
区和![]() 区________。
区________。
(2)有的同学受这种划分的启发,认为![]() 区内第6、7纵行的部分元素可以排在另一区,你认为应排在______区。
区内第6、7纵行的部分元素可以排在另一区,你认为应排在______区。
(3)请在上述元素周期表中用元素符号标出![]() 轨道处于半充满状态的元素________。
轨道处于半充满状态的元素________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2O是黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或加热时会发生燃烧并爆炸。制取Cl2O的装置如图所示。
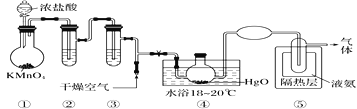
已知:Cl2O的熔点为-116 ℃,沸点为3.8 ℃,Cl2O在空气中的百分含量达到25%以上易爆炸;Cl2的沸点为-34.6 ℃;HgO+2Cl2==HgCl2+Cl2O。下列说法中不正确的是
A.装置②③中盛装的试剂依次是饱和食盐水和浓硫酸
B.通入干燥空气的目的是将生成的Cl2O稀释,减小爆炸危险
C.从装置⑤中逸出气体的主要成分是Cl2O
D.装置④与⑤之间不用橡胶管连接,是为了防止橡胶管燃烧和爆炸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼与![]() 是常用的火箭推进剂,二者发生如下化学反应:
是常用的火箭推进剂,二者发生如下化学反应:
![]() Ⅰ
Ⅰ![]()
![]() 反应
反应![]() Ⅰ
Ⅰ![]() 中氧化剂是 ______ 。
中氧化剂是 ______ 。
![]() 火箭残骸中常现红棕色气体,原因为:
火箭残骸中常现红棕色气体,原因为:![]()
![]() Ⅱ
Ⅱ![]()
当温度升高时,气体颜色变深,则反应![]() Ⅱ
Ⅱ![]() 为 ______
为 ______ ![]() 填“吸热”或“放热”
填“吸热”或“放热”![]() 反应。
反应。
![]() 一定温度下,反应
一定温度下,反应![]() Ⅱ
Ⅱ![]() 的焓变为
的焓变为![]() 现将
现将![]() 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是 ______ 。
充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是 ______ 。
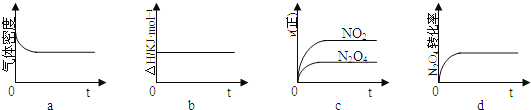
若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数 ______ ![]() 填“增大”、“不变”或“减小”
填“增大”、“不变”或“减小”![]() ,反应3s后
,反应3s后![]() 的物质的量为
的物质的量为![]() ,则
,则![]() 的平均反应速率
的平均反应速率 ______
![]() 。
。
![]() 硝酸厂的尾气中含
硝酸厂的尾气中含![]() 和NO,直接排放将污染空气.目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
和NO,直接排放将污染空气.目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
![]()
![]()
则甲烷直接将![]() 还原为
还原为![]() 的热化学方程式为:_________________________________________。
的热化学方程式为:_________________________________________。
![]() 氨气在纯氧中燃烧,也可生成上述反应
氨气在纯氧中燃烧,也可生成上述反应![]() Ⅰ
Ⅰ![]() 产物中的两种.科学家利用此原理,设计成氨气
产物中的两种.科学家利用此原理,设计成氨气![]() 氧气燃料电池,则通入氨气的电极是 ______
氧气燃料电池,则通入氨气的电极是 ______ ![]() 填“正极”或“负极”
填“正极”或“负极”![]() ;碱性条件下,该电极发生反应的电极反应式为__________________________________________________。
;碱性条件下,该电极发生反应的电极反应式为__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在固定容积的容器中,可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
A. 刚充入时反应速率υ正减少,υ逆增大 B. 平衡不发生移动
C. 平衡向正反应方向移动,A的物质的量浓度减小 D. 物质C的质量分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、U、W 是原子序数依次增大的前四周期元素。其中 Y 的原子核外有 7 种运动状态不同的 电子;X、Z 中未成对电子数均为 2;U 是第三周期元素形成的简单离子中半径最小的元素;W 的内层电 子全充满,最外层只有 1 个电子。请回答下列问题:
(1)U 在周期表中的位置 。X、Y、Z 的第一电离能从大到小的顺序是 (用元素符号表示,下同)。
(2)写出 W 的价电子排布图 。
(3)根据等电子体原理,可知化合物 XZ 的电子式是 。
(4)X、Y、Z的最简单氢化物的键角从大到小的顺序是 ( 用化学式表示), 原因 是 。
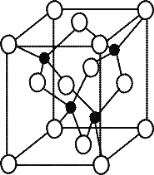
(5)由元素 Y 与 U 元素组成的化合物 A,晶胞结构如右图所示(黑球表示 Y 原子, 白球表示 U 原子),请写出化合物 A 的化学式 ,其中 Y 元素的杂化方式是 。
(6)U 的晶体属立方晶系,其晶胞边长为 405 pm,密度是 2.70 g/cm,通过计算确定 其晶胞的类型 (填简单立方堆积、体心立方堆积或面心立方最密堆 积)(已知:4053≈6.64×107)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com