


科目:高中化学 来源: 题型:
| 350℃ |
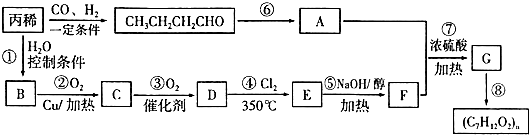
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1,3-丁二烯和2-丁炔相互转化的焓变△H |
| B、1,3-丁二烯和2-丁炔分子的稳定性 |
| C、1,3-丁二烯和2-丁炔的燃烧热热值的相对大小 |
| D、2-丁炔中一个碳碳三键能与1,3-丁二烯中两个碳碳双键键能之和的相对大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向少量溶液X中滴加适量新制氯水,再加几滴KSCN溶液后变红,说明X中一定含有Fe2+ |
| B、向1mL1%的NaOH溶液中加入21mL1%的CuSO4溶液,振荡后再加入0.51mL有机物X,加热后来出现砖红色沉淀,说明X结构中不含有醛基 |
| C、向CuSO4溶液中加入Kl溶液,有白色沉淀生成,再加入四氯化碳振荡,四氯化碳呈紫色,说明白色沉淀可能为Cul |
| D、在合成氨工业中,移走NH3,可增大正反应速率,提高原料转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生铁不需要特殊处理就有很强的抗腐蚀能力 |
| B、手机中锂离子电池属于二次电池 |
| C、“地沟油”经过加工处理制得肥皂或生物柴油,可以实现厨余废物的合理利用 |
| D、以NaClO为有效成分的漂白液可以作为游泳池的消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电子不停地做高速运动 |
| B、电子在核外是分层排布的 |
| C、每个电子层作为最外层时,最多可容纳8个电子 |
| D、离原子核近的电子能量低,离原子核远的电子能量高 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 表一 | ||
| 序号 | A溶液 | B溶液 |
| 2mL 0.2mol/LH2C2O4溶液 | 4mL 0.01mol/LKMnO4溶液 | |
| 2mL 0.1mol/LH2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 | |
| 2mL 0.2mol/LH2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液和少量MnSO4 | |
| 实验编号 | 1 | 2 | 3 | 4 |
| 水/mL | 10 | 5 | 0 | X |
| 0.5mol/L H2C2O4/mL | 5 | 10 | 10 | 5 |
| 0.2mol/L KMnO4/mL | 5 | 5 | 10 | 10 |
| 时间/s | 40 | 20 | 10 | --- |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、闭合K1构成原电池,闭合K2构成电解池 |
| B、K1闭合,铁棒上发生的反应为:Fe-2e-═Fe2+ |
| C、K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 |
| D、K1闭合,石墨棒周围溶液PH逐渐升高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com