
分析 两种可能:一是发生氧化还原反应:2Fe3++SO32-+H2O═2Fe2++SO42-+2H+;二是发生双水解反应:2Fe3++3SO32-+3H2O=2Fe(OH)3↓+3SO2↑.
实验I:观察到无气泡产生,无沉淀生成,但溶液颜色最终变为红褐色,可知生成氢氧化铁胶体,加盐酸时先聚沉后溶解;
将所得溶液加入BaCl2稀溶液,有少量白色沉淀生成,白色沉淀为硫酸钡;
实验Ⅱ:现象相同,可知都生成胶体,都有硫酸钡生成;
综上所述,氧化还原反应与相互促进水解反应均发生,药品中亚硫酸钠可能变质混有硫酸钠,以此来解答.
解答 解:两种可能:一是发生氧化还原反应:2Fe3++SO32-+H2O═2Fe2++SO42-+2H+;二是发生双水解反应:2Fe3++3SO32-+3H2O=2Fe(OH)3↓+3SO2↑.
实验I:观察到无气泡产生,无沉淀生成,但溶液颜色最终变为红褐色,可知生成氢氧化铁胶体,加盐酸时先聚沉后溶解,这种红褐色液体是Fe(OH)3胶体;
将所得溶液加入BaCl2稀溶液,有少量白色沉淀生成,白色沉淀为硫酸钡,发生的离子反应为;
实验Ⅱ:现象相同,可知都生成胶体,都有硫酸钡生成;
综上所述,Fe3+和SO32-在溶液中既发生氧化还原反应,又发生互促水解反应;
该设计有缺陷,应在开始实验前对某主要药品进行检验,该主要药品为Na2SO3溶液;检验的目的是,
故答案为:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;2Fe3++3SO32-+3H2O=2Fe(OH)3↓+3SO2↑;③Fe(OH)3胶体;Ba2++SO42-=BaSO4↓;Fe3+和SO32-在溶液中既发生氧化还原反应,又发生互促水解反应;Na2SO3溶液;判断反应前Na2SO3溶液是否已经部分被氧化.
点评 本题考查性质实验方案的设计,为高频考点,把握物质的性质、发生的反应为解答该题的关键,侧重分析和实验能力的考查,注意氧化还原反应及水解原理的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 任何酸与碱反应生成1 mol H2O的过程中,放出的热量均相同 | |
| B. | 等量的硫蒸气和硫固体分别完全燃烧,前者放出热量多 | |
| C. | 光照时,H2(g)+Cl2(g)═2HCl(g)△H=aKJ/mol;若反应条件变为点燃,△H将减少 | |
| D. | 表示碳燃烧热的热化学方程式为:2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
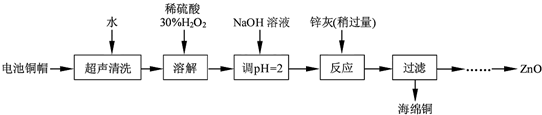
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使溴水褪色 | B. | 乙醇与浓硫酸共热至170℃ | ||
| C. | 溴乙烷与NaOH水溶液共热 | D. | 在液溴与苯的混合物中撒入铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com