
有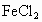 、
、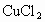 的混合溶液400mL,经测是其中
的混合溶液400mL,经测是其中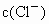 是amol/L,向其中投入bg锌粉(过量),充分反应后,过滤.所得滤渣的质量为cg.
是amol/L,向其中投入bg锌粉(过量),充分反应后,过滤.所得滤渣的质量为cg.
(1)求原混合溶液中 、
、 的物质的量浓度.
的物质的量浓度.
(2)b的数值范围是___________(用含a的代数式表示).
(3)c的数值越大,说明原混合溶液中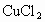 的含量___________(填“越大”、“越小、”),c的最小值应为_________(用含a、b的代数式表示).
的含量___________(填“越大”、“越小、”),c的最小值应为_________(用含a、b的代数式表示).
科目:高中化学 来源: 题型:022
有FeCl2、CuCl2混合溶液400 ml,经测定,其中[Cl-]为a mol/L,投入b g锌粉(过量),充分反应后,过滤,所得固体残渣经洗涤、干燥后,质量为c g。(只考虑金属与盐的反应)。
(1)原混合溶液中Fe2+、Cu2+的物质的量浓度为[Fe2+]=________;[Cu2+]=________。
(2)b>________a。
(3)c的数值越大,说明混合溶液中CuCl2含量________。
(4)c的取值范围为________(以a、b表示)。
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:022
(1)原混合溶液中Fe2+、Cu2+的物质的量浓度为[Fe2+]=________;[Cu2+]=________。
(2)b>________a。
(3)c的数值越大,说明混合溶液中CuCl2含量________。
(4)c的取值范围为________(以a、b表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)原混合溶液中离子的物质的量浓度为:c(Fe2+)=___________c(Cu2+)=___________。
(2)b的数值>___________。
(3)c的数值越大。说明混合溶液中CuCl2含量___________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年重庆市高三上学期12月月考理综化学试卷(解析版) 题型:填空题
合成氨和制备硝酸是两种重要的化工生产,重庆某化工厂将合成氨与制备硝酸进行连续生产。
(1)在某温度下体积为200 L的氨合成塔中,以分为单位的时间点上测得各物质的浓度(mol·L﹣1)如下表:
|
|
0 min |
l min |
2 min |
3 min |
4 min |
|
N2 |
1.500 |
1.400 |
1.200 |
c1 |
c1 |
|
H2 |
4.500 |
4.200 |
3.600 |
c2 |
c2 |
|
NH3 |
0 |
0.200 |
0.600 |
c3 |
c3 |
根据表中数据得知0 min~2 min内N2的平均反应速率是_______,若3 min末N2的转化率为a,则此时H2的转化率为_______ (用含a的代数式表示)。
(2)今对合成氨反应进行如下研究:在容积均为10 L的a、b、c三个相同密闭容器中分别充入1 mol N2和3 mol H2,三个容器的反应温度分别为T1、T2、T3,在其他条件相同情况下,实验测得反应均进行到5 min时,NH3的体积分数如图所示。则下列说法正确的是_______。

A.a、b、C三容器5 min时的正反应速率大小为:b>a>c
B.达到平衡时,a、b、c中N2转化率为a>b>c
C.5min时,a、b、c三容器中的反应均可能达到平衡状态。
D.将容器b中的平衡状态转变到容器c中的平衡状态,可采取的措施有升温或减压
(3)已知:N2(g)+O2(g)=2NO(g): △H=+180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=﹣905 kJ/mol
2H2(g)+O2(g)=2H2O(g); △H=﹣483.6 kJ/mol
则在该条件下,氨合成塔中所发生反应的热化学方程式为:____________________________;
(4)金属Cu单独与氨水或单独与双氧水都不反应,但可与二者的混合溶液反应生成深蓝色溶液,写出该反应的离子方程式:_________________________________________;
(5)取200 mL的硝酸恰好与32 g Cu2S完全反应,已知硝酸被还原成等物质的量的NO和NO2,另外还有CuSO4和Cu(NO3)2生成,则所得工业硝酸的浓度是_______mol·L﹣1。
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com