
| A. | 除③外 | B. | 除④外 | C. | 除③④外 | D. | 除②⑥外 |
分析 ①C与O2反应充分和不充分时,产物不同;
②Na与O2反应在不同条件下产物不同;钠在氧气中加热反应生成过氧化钠,在氧气中常温下反应生成氧化钠,产物不同;
③铁和氯气反应只能将铁氧化为正三价;
④氯化铝溶液和氨水反应生成氢氧化铝沉淀;氢氧化铝和弱碱不反应;
⑤少量二氧化碳和烧碱反应生成碳酸盐,二氧化碳过量时生成碳酸氢钠;
⑥铜和浓硝酸以及稀硝酸反应生成的产物不同.
解答 解:①C与O2反应充分时生成二氧化碳,不充分时生成一氧化碳,产物不同,故①正确;
②钠在氧气中加热反应生成过氧化钠,在氧气中常温下反应生成氧化钠,产物不同,故②正确;
③铁和氯气反应只能将铁氧化为正三价,反应条件、用量、浓度等不同时所发生的化学反应相同,故③错误;
④AlCl3溶液与氨水反应生成氢氧化铝沉淀,氢氧化铝和弱碱不反应,故④错误;
⑤少量二氧化碳和烧碱反应生成碳酸盐,二氧化碳过量时生成碳酸氢钠,产物不同,故⑤正确;
⑥铜和浓硝酸反应生成二氧化氮,与稀硝酸反应生成一氧化氮,产物不同,故⑥正确;
故选C.
点评 本题考查学生物质之间反应时,用量的多少,反应条件的不同,对反应产物会产生影响,可以根据所学知识来回答,难度中等.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | 用100 mL容量瓶配制50 mL 0.1 mol/L盐酸 | |
| B. | 在托盘天平上称量NaOH时,应将NaOH固体放在小烧杯中称量 | |
| C. | 用25 mL量筒量取4.0 mol/L的盐酸5.62 mL | |
| D. | 用托盘天平准确称取5.85 g NaCl固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CO可用于合成甲醇.在压强为0.1MPa条件下,在体积 为bL的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇:
CO可用于合成甲醇.在压强为0.1MPa条件下,在体积 为bL的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合金贮氢材料具有优异的吸放氢性能,在配合氢能的开发中起到重要作用.
合金贮氢材料具有优异的吸放氢性能,在配合氢能的开发中起到重要作用.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
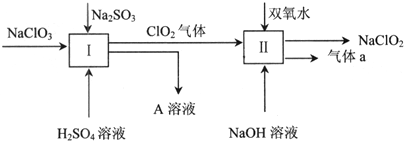
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取ag混合物充分加热,剩余bg固体 | |
| B. | 取ag混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重bg | |
| C. | 取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得bg固体 | |
| D. | 取ag混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得bg固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com