
【题目】过氧化钙(CaO2·8H2O)是一种在水产养殖中广泛使用的供氧剂。
(1)Ca(OH)2悬浊液与H2O2溶液反应可制备CaO2·8H2O。
Ca(OH)2+H2O2+6H2O![]() CaO2·8H2O,反应时通常加入过量的Ca(OH)2,其目的是____________。
CaO2·8H2O,反应时通常加入过量的Ca(OH)2,其目的是____________。
(2)向池塘水中加入一定里的CaO2·8H2O后,池塘水中浓度增加的离子有___________(填序号)。
A.Ca2+ B.H+ C.CO32- D.OH-
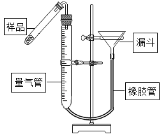
(3)CaO2在受热时能分解成CaO和O2。如图是测定样品中CaO2含量的装置。
①检查装置气密性的方法是:________________。
②加热小试管中的样品时,随着过氧化钙分解,量气瓶内的液面逐渐下降,为防止试管和量气瓶内气体压强过大,可将漏斗_______________(填“上提”或“下移”) 。
(4)水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置,加入适量稀H2SO4,待MnO(OH)2与I-完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:
![]()
写出O2将Mn2+氧化成MnO(O H)2的离了方程式:______________。
②取加过一定量CaO2·8H2O的池塘水样l00.00ml,按上述方注测定水中溶解氧量,消耗0.01000mol/L Na2S2O3标准溶液13.50 ml.计算该水样中的溶解氧(用mg·L-1表示), 写出计算过程。
【答案】(1)提高H2O2的利用率;
(2)AD;
(3)①连接好装置,从漏斗中注水,量气管两边形成一定的高度差,作好标记,一段时间后高低差不变,证明气密性良好;②下移;
(4)①2Mn2++O2+4OH-=2MnO(OH)2↓;②10.80mg/L。
【解析】
试题分析:(1)依据方程式Ca(OH)2+H2O2+6H2O=CaO2·8H2O可知,反应时加入氢氧化钙是为提高H2O2的利用率;(2)过氧化钙与水反应生成氢氧化钙、氧气和水,因此箱池水塘中加入一定量的CaO2·8H2O,池塘水中浓度增加的离子有钙离子和氢氧根离子,正确选项是AD;(3)①该实验有气体生成,要收集气体,就要检查装置的气密性。检查装置气密性的方法是连接好装置,从漏斗中注水,量气管两边形成一定的高度差,作好标记,一段时间后高低差不变,证明气密性良好;加热小试管中的样品时,随着过氧化钙分解,量气瓶内的液面逐渐下降,为防止试管和量气瓶内气体压强过大,可将漏斗下移;(4)①O2将Mn2+氧化成MnO(OH)2的反应中O2是氧化剂得到4个电子,Mn元素的化合价从+2价升高到+4价,失2个电子,所以根据电子得失守恒以及原子守恒可知反应的离子方程式为:2Mn2++O2+ 4OH-= 2MnO(OH)2↓;②滴定反应的离子方程式是I2+2S2O32-=2I-+S4O62-,n(I2)=[c(Na2S2O3)V(Na2S2O3)]÷2=(0.1000mol/L×13.50mL×103L/mol)÷2=6.750×10-5mol,n[MnO(OH2]= n(I2)==6.750×10-5mol,n(O2)= n[MnO(OH2]÷2=3.375×10-5mol,所以水中溶解氧=(3.375×105mol×32g/mol×1000mg/g)÷(100.00mL×103L/mL)=10.80mg/L。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某地环保部门取一定量某工厂所排废水试样分成甲、乙、丙、丁四份,进行如图所示探究。

已知废水试样中可能含有下表中的离子:
阳离子 | Na+、Mg2+、X |
阴离子 | Cl-、SO、Y、NO |
(1)离子X是________(填化学式,下同),离子Y是________。
(2)表中不能确定是否存在的阴离子是________,能证明该阴离子是否存在的简单实验操作为______________________________________________
(3)丁组实验在酸性条件下发生反应的离子方程式是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】减少二氧化碳的排放是一项重要课题。
(1)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g) ![]() C2H4(g)+4H2O(g) △H
C2H4(g)+4H2O(g) △H
在0.1 MPa时,按![]() =1:3投料,图所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系。
=1:3投料,图所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系。
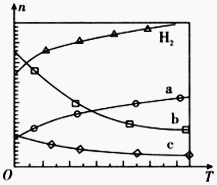
①该反应的△H__________0(填“>”、“=”或“<”)。
②曲线b表示的物质为__________。
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是__________。
(2)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如图所示。
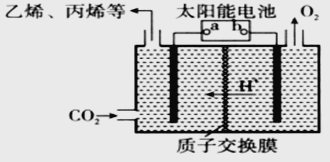
①该工艺中能量转化方式主要有_________。
②b为电源的________(填“正”或“负”)极,电解时,生成乙烯的电极反应式是_________。
(3)以CO2为原料制取碳(C)的太阳能工艺如图所示。
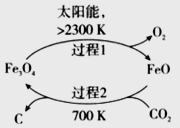
①过程1每反应1mol Fe3O4转移电子的物质的量为__________。
②过程2发生反应的化学方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 元素周期律是元素原子核外电子排布周期性变化的结果
B. HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱
C. 第三周期非金属元素含氧酸的酸性从左到右依次增强
D. 形成离子键的阴、阳离子间只存在静电吸引力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质分类的叙述正确的是( )
A.NaCl晶体不导电,所以NaCl是非电解质
B.Na2O2能与酸反应,所以Na2O2是碱性氧化物
C.BaSO4难溶于水,但BaSO4是强电解质
D.NH4Cl不含有金属离子,所以NH4Cl不是盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计实验,用浓硫酸与铜反应制得SO2并进行相关实验探究。
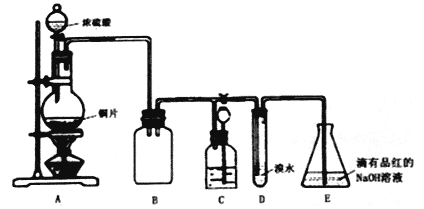
(1)装置A中发生反应的化学方程式是____________,装置B的作用是____________。
(2)设计装置D的目的是验证SO2的_____________性,E中NaOH全部转化为NaHSO3的标志是____________。
(3)装置C的作用是贮存多余的气体,C中应放置的液体是________。
(4)反应结束时烧瓶中Cu有剩余,某同学认为H2SO4也有剩余,他设计了下列实验方案来测定剩余H2SO4的量。经冷却,定量稀释后进行下列实验,能达到目的是________(填序号);
a.用酸碱中和滴定法测定 b.与足量Zn反应,测量生成H2的体积
c.用pH计测溶液pH值 d.与足量BaCl2溶液反应,称量生成沉淀的质量
(5)向E瓶所得NaHSO3溶液中加入漂白粉溶液,反应有三种可能情况:
I. HSO3-与ClO-刚好反应完; II. 漂白粉不足; III. 漂白粉过量
同学们分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请你完成下表:
实验序号 | 实验操作 | 现象 | 反应的可能情况 |
① | 滴加少量淀粉碘化钾溶液,振荡 | III | |
② | 滴加少量棕红色的KI3溶液,振荡 | II | |
③ | 滴入加少量酸性KMnO4溶液,振荡 | 溶液呈紫色 | |
④ | 加入几小块CaCO3固体 | 有气泡产生 |
(6)请设计简单实验证明室温下HSO3-的电离平衡常数Ka与水解平衡常教Kb的相对大小_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.乙烯的结构简式可以表示为CH2CH2
B.苯、乙醇和乙酸都能发生取代反应
C.丙烯所有原子可能在一个平面上
D.水煤气和天然气的主要成分都是甲烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列曲线图(纵坐标为沉淀的量,横坐标为加入物质的量)与对应的选项相符合的是( )


A.向1 L浓度均为0.1 mol·L-1的Ba(OH)2、NaAlO2混合溶液中加入0.1 mol·L-1的稀H2SO4
B.向1 L浓度分别为0.1 mol·L-1和0.3 mol·L-1的AlCl3、NH4Cl的混合溶液中加入0.1 mol·L-1的稀NaOH溶液
C.向烧碱溶液中滴加明矾溶液
D.向AlCl3溶液中滴加过量氨水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com