
| A.标准状况下,22.4 L CO2含有的分子数为NA |
| B.将10.6 g Na2CO3溶于水,电离出Na+的数目为0.2 NA |
| C.1 mol CuO被还原成Cu,得到电子数目为2 NA |
| D.1 L 0.5 mol/L的FeCl3溶液中,含有Cl-数目为 0.5 NA |


 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源:不详 题型:单选题
| A.分子数 | B.质量 | C.电子数 | D.密度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.KCl、Na2SO4 | B.KCl、Na2SO4、NaCl |
| C.NaCl、Na2SO4、K2SO4 | D.KCl、K2SO4、Na2SO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2×107L | B. L L | C.2×107×22.4 L | D. ×22.4 L ×22.4 L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③④ | B.③④ | C.①②③⑤ | D.①③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
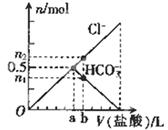
| A.Oa段反应的离子方程式与ab段反应的离子方程式相同 |
| B.该碳酸钠溶液中含有1mol Na2CO3 |
| C.b点的数值为0.6 |
| D.b点时生成CO2的物质的量为0.3 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1 mol/L | B.0.5 mol/L | C.0.6 mol/L | D.0.1 mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.0.02mol·L-1的NaCl溶液 | B.0.01mol·L-1的CaCl2溶液 | C.0.01mol·L-1的蔗糖溶液 | D.0.02mol·L-1的CH3COOH溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.甲的物质的量比乙的物质的量少 |
| B.甲气体所占体积比乙气体所占体积大 |
| C.甲相对分子质量比乙相对分子质量小 |
| D.甲气体摩尔体积比乙气体摩尔体积小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com