
化学与生产、生活、科技、环境等密切相关。下列说法正确的是
A. 地沟油禁止用于食品用油,但可以用于制肥皂和生物柴油
B. 石油裂解、海水晒盐、纤维素制火棉都包含化学变化
C. 糖类、油脂和蛋白质在人体内均被水解为人体能直接吸收的有机物
D. “嫦峨三号”使用的碳纤维是一种新型的有机高分子材料
科目:高中化学 来源:2017届江西省九江市十校高三第二次联考理科综合化学试卷(解析版) 题型:填空题
A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布布式为 。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;A和B的氢化物所属的晶体类型分别为 和 。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为 ,中心原子的杂化轨道类型为 。
(4)化合物D2A的立体构型为 ,中心原子的价层电子对数为 ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 。
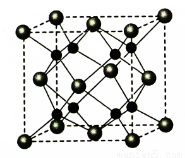
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm,F 的化学式为 :晶胞中A 原子的配位数为 ;列式计算晶体F的密度(g.cm-3) 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省大同市高一3月月考化学试卷(解析版) 题型:选择题
几种短周期元素的原子半径及某些化合价见下表。分析判断下列说法正确的是( )
元素代号 | A | B | D | E | G | I | J | K | |
化合价 | -1 | -2 | +4 -4 | +7 -1 | +5 -3 | +3 | +2 | +1 | |
原子半径/ nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 | |
A. A的单质是一种常见的还原剂 B. E的含氧酸酸性比D的含氧酸酸性强
C. A、I、J的商子半径由大到小顺序是A>J>I D. A的气态氢化物是强酸
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三3月月考理科综合化学试卷(解析版) 题型:选择题
化学离不开生活,生活也离不开化学。下列叙述中科学的是
A. 广告语“农家肥蔬菜,无公害,绝对不含任何化学物质”
B. 医用酒精是利用了乙醇的氧化性来杀菌消毒的
C. 面食加工时加入少量苏打粉时是防止酸败,加入少量小苏打粉时是作膨松剂
D. 空气质量日报中计入污染指数的项目为可吸入颗粒物、SO2、NOx、CO2
查看答案和解析>>
科目:高中化学 来源:河北省2017届高三下学期三调考试理科综合化学试卷 题型:选择题
分子式为C5H10O2且能与NaOH溶液反应的有机物有(不含立体异构)
A. 13种 B. 4种 C. 9种 D. 16种
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省太原市高一3月阶段性测试化学试卷(解析版) 题型:填空题
下表是元素周期表的一部分.
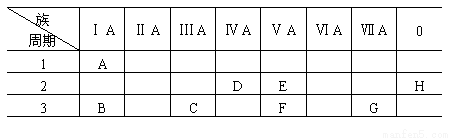
(1)写出元素符号: A________、F________。
(2)根据A~H元素在周期表中的位置,选适当的化学式或方程式填入空白处。
①单质中氧化性最强的是________,还原性最强的是________。
②最高价氧化物对应水化物碱性最强的是________,气态氢化物水溶液酸性最强的是_______。
③写出C的单质与B的最高价氧化物水化物溶液反应的离子方程式_________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省太原市高一3月阶段性测试化学试卷(解析版) 题型:选择题
一定质量的铜分别与足量的稀硝酸和浓硝酸完全反应,在相同条件下用排水法收集反应产生的气体,下列叙述正确的是( )
A.硝酸浓度越大,反应消耗的硝酸越少
B.硝酸浓度不同,生成Cu(NO3)2的物质的量不同
C.硝酸浓度越大,产生的气体越少
D.两者排水法收集到的气体体积相等
查看答案和解析>>
科目:高中化学 来源:2017届新疆乌鲁木齐地区高三第二次诊断性测验化学试卷(解析版) 题型:简答题
硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。利用方铅矿精矿( PbS)直接制备硫酸铅粉末的流程如下:
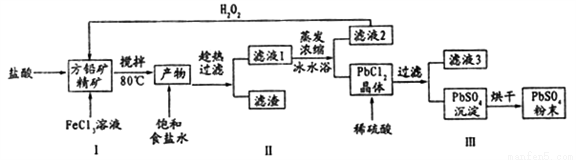
已知:(i) PbCl2 (s)+2C1-(aq)=PbCl42-(aq) △H>0
(ii)有关物质的Ksp和沉淀时的pH如下:
物质 | Ksp | 物质 | 开始沉淀时pH | 完全沉淀时pH |
PbSO4 | 1.0×10-8 | Fe(OH)3 | 2.7 | 3.7 |
PbCl2 | 1.6×10-5 | Pb(OH)2 | 6 | 7.04 |
(1)步骤I反应加入盐酸后可以观察到淡黄色沉淀生成,请写出的离子方程式___________。
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因____________。
(3)在上述生产过程中可以循环利用的物质有______________。
(4)写出步骤Ⅲ中PbCl2晶体转化为PbSO4沉淀的离子方程式________________。
(5)铅的冶炼、加工会使水体中重金属铅的含量增大造成严重污染。某课题组制备了一种新型脱铅剂(用EH表示),能有效去除水中的痕量铅,脱铅过程中主要发生的反应为:2EH(s)+Pb2+ E2Pb(s)+2H+。则脱铅的最合适的pH范围为____(填编号)
E2Pb(s)+2H+。则脱铅的最合适的pH范围为____(填编号)
A.4~5 B.6~7 C.9~10 D.11~12
(6)PbSO4热激活电池可用作火箭、导弹的工作电源。基本结构如图所示,其中作为电解质的无水LiCl-KC1混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。
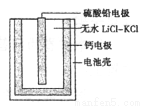
①放电过程中,Li+向_______移动(填“负极”或“正极”)。
②负极反应式为_____________。
③电路中每转移0.2mol电子,理论上生成_________g Pb。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省桂林市高一下学期开学考试化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A. 钠投入氯化亚铁溶液中:2Na+Fe2+===2Na++Fe
B. AlCl3溶液中加入过量的氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH4+
C. Fe3O4溶于稀硝酸中:Fe3O4+8H+===Fe2++2Fe3++4H2O 
D. 澄清石灰水中加入过量的NaHCO3溶液:Ca2++OH-+HCO3-===CaCO3↓+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com