
| A. | 乙烯的结构简式可表示为CH2CH2 | B. | 乙醇的分子式:CH3CH2OH | ||
| C. | 甲烷的结构式:CH4 | D. | 甲苯的键线式可表示为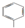 |
分析 A.烯、炔的结构简式碳碳双键、碳碳三键不能省略;
B.分子式 中相同原子合并;
C.用短线“-”代替共用电子对甲烷结构式;
D.只用键线来表示碳架,两根单键之间或一根双键和一根单键之间的夹角为120?,一根单键和一根三键之间的夹角为180?,而分子中的碳氢键、碳原子及与碳原子相连的氢原子均省略,据此解答即可.
解答 解:A.乙烯结构简式中碳碳双键不能省略,乙烯的结构简式为CH2═CH2,故A错误;
B、乙醇的分子式为C2H6O,故B错误;
C.甲烷分子式为CH4,碳原子与氢原子之间形成1对共用电子对,结构式为 ,故C错误;
,故C错误;
D.甲苯是由甲基和苯环构成的,此键线式正确,故D正确,
故选D.
点评 本题考查有机物的结构与性质,涉及知识点较全,注意把握命名、电子式、结构及物质的性质即可解答,注重基础知识的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 |  |  |  |
| 验证化学能转化为电能 | 验证非金属性:Cl>C>Si | 实验室制氨气 | 研究催化剂对化学反应速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强恒定不变 | |
| B. | 混合气体的密度不再改变 | |
| C. | H2、I2、HI的浓度相等 | |
| D. | I2在混合气体中的体积分数不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义.
研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 含有离子键的化合物一定是离子化合物 | |
| C. | 由共价键形成的物质一定是共价化合物 | |
| D. | 非金属原子间形成的化学键一定是共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{n}{16+A}$(A-N+8)mol | B. | $\frac{n}{16+A}$(A-N+10)mol | C. | (A-N+2)mol | D. | $\frac{n}{A}$(A-N+6)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 化学反应中能量变化的主要原因是化学键的断裂与形成 | |
| B. | 中和反应中,反应物的总能量比生成物的总能量高 | |
| C. | 图I所示的装置能将化学能转变为电能 | |
| D. | 图II所示的反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com