
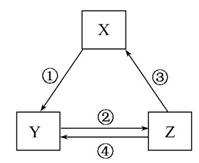
下表各组物质之间通过一步反应不可以实现如下图所示转化关系的是( )
| 选项 | X | Y | Z | 箭头上所标数字的反应条件 |
| A | CaO | Ca(OH)2 | CaCO3 | ①常温加水 |
| B | AlCl3 | NaAlO2 | Al(OH)3 | ②通入CO2 |
| C | Fe | FeCl2 | FeCl3 | ④加入铁粉 |
| D | Cl2 | Ca(ClO)2 | HClO | ③加浓盐酸 |
科目:高中化学 来源: 题型:
可逆反应N2(g)+3H2(g)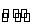 2NH3(g) ΔH<0,达到平衡后,为了使氢气的转化率增大,下列选项中采用的三种方法正确的是( )
2NH3(g) ΔH<0,达到平衡后,为了使氢气的转化率增大,下列选项中采用的三种方法正确的是( )
A.升高温度、降低压强、增加氮气
B.降低温度、增大压强、加入催化剂
C.升高温度、增大压强、增加氮气
D.降低温度、增大压强、分离出部分氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
铝及铝合金经过阳极氧化,铝表面能生成几十微米厚的氧化铝膜。某研究性学习小组对铝表面氧化膜的保护作用展开了研究,他们查阅有关资料得知:尽管铝表面致密的氧化膜能使铝与其周围的介质(如空气、水等)隔绝,对铝制品起到保护作用,但铝制容器仍不能长期盛放或腌制咸菜。该小组同学设计了一个实验以探究其中的原因。他们的实验过程如下所示:
| 实验 | ||
| 编号 | 实验过程 | 实验现象 |
| 1 | 取一小片铝片于试管中,加入2 mL 1.0 mol·L-1盐酸 | 30 s时开始有少量气泡,然后产生气泡的速率逐渐加快,最后铝片消失 |
| 2 | 取一小片铝片于试管中,加入2 mL 0.5 mol·L-1硫酸 | 55 s时开始有少量气泡,然后产生气泡的速率逐渐加快,最后铝片消失 |
| 3 | 取一小片铝片于试管中,加入氯化铜稀溶液 | 3 min左右表面产生少量气泡,且铝表面析出一些红色固体 |
| 4 | 取一小片铝片于试管中,加入硫酸铜稀溶液 | 一直没有明显的变化 |
(1)你认为实验1、2中盐酸和硫酸的浓度分别为1.0 mol·L-1、0.5 mol·L-1的原因是__________________________________。
(2)根据该实验现象,你认为铝制容器不能长期盛放或腌制咸菜的原因是__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于化学反应速率的说法正确的是( )
A.化学反应速率是指一定时间内任何一种反应物浓度的减少或任何一种生成物浓度的增加
B.化学反应速率为0.8 mol·L-1·s-1是1 s时某物质的浓度为0.8 mol·L-1
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.对于任何化学反应来说,反应速率越大,反应现象就越明显
查看答案和解析>>
科目:高中化学 来源: 题型:
在2 L密闭容器中进行反应:
mX(g)+nY(g)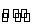 pZ(g)+qQ(g),式中m,n,p,q为物质的化学计量数。在0~3 min 内,各物质物质的量的变化如下表所示:
pZ(g)+qQ(g),式中m,n,p,q为物质的化学计量数。在0~3 min 内,各物质物质的量的变化如下表所示:
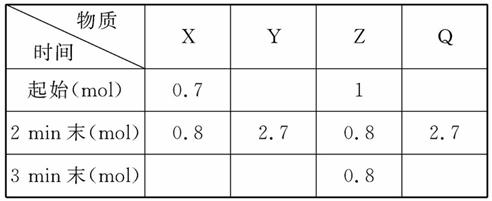
已知2 min内v(Q)=0.075 mol·L-1·min-1,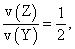
(1)试确定以下物质的相关量:
起始时n(Y)=__________,n(Q)=________。
(2)方程式中m=__________,n=_________,
p=____________,q=___________。
(3)用Z表示2 min内的反应速率_________。
(4)2 min末Q的转化率为____________。
(5)试判断在2 min内v(正)________v(逆)(填“>”“<”或“=”),在2 min末~3 min末v(正)_________v(逆)(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。已知高铁酸盐热稳定性差,工业上用湿法制备高铁酸钾的基本流程如下图所示:
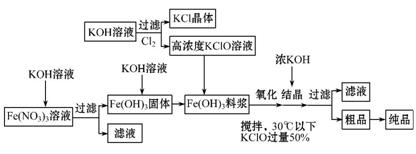
(1)上述氧化过程中,发生反应的离子方程式是 ,
控制反应温度30℃以下的原因是 。
(2)结晶过程中加入浓KOH溶液的作用是 。
(3)已知常温下Ksp[Fe(OH)3]=1.25×10-36,则Fe(NO3)3溶液中加入KOH溶液到
pH= 时,Fe3+才能完全沉淀(当溶液中某种离子浓度小于10-5mol·L-1时可看作完全沉淀,lg2=0.3,lg5=0.7),常温下反应Fe3++3H2O Fe(OH)3+3H+的平衡常数K= [水解生成的Fe(OH)3为胶体,其浓度不代入计算式,写出计算结果]。
Fe(OH)3+3H+的平衡常数K= [水解生成的Fe(OH)3为胶体,其浓度不代入计算式,写出计算结果]。
(4)最近,工业上用表面附有铁的氧化物的铁丝网作阳极,电解KOH溶液制备K2FeO4,优点是原料价廉,效率高。若用一表面附有Fe3O4的铁丝网20.0 g作阳极电解,当电路中通过1.4 mol电子时,铁丝网恰好电解完全。此时生成K2FeO4的质量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
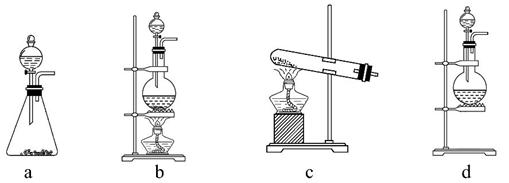
下列与金属腐蚀有关的说法正确的是( )
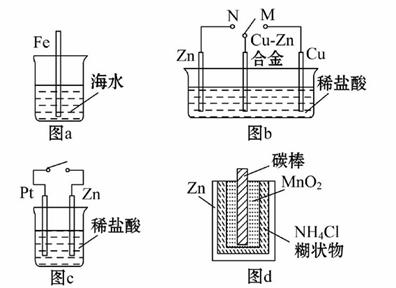
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C.图c中,接通开关时,Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn-MnO2干电池的放电腐蚀主要是由MnO2的氧化作用引起的
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验装置进行的相应实验,能达到实验目的的是( )
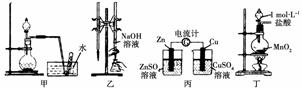
A.用图甲装置进行稀硝酸与铜的反应制取并收集NO
B.用图乙装置进行用已知浓度的氢氧化钠溶液测定盐酸浓度的实验
C.用图丙装置检验电流的方向
D.用图丁装置制取少量Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组查阅资料得知,漂白粉与硫酸反应可以制得氯气,化学方程式为:
Ca(ClO)2+CaCl2+2H2SO4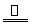 2CaSO4+2Cl2↑+2H2O。他们设计了如下制取氯气并验证其性质的实验。
2CaSO4+2Cl2↑+2H2O。他们设计了如下制取氯气并验证其性质的实验。
试回答:(1)该实验中A部分的装置是 (填写装置的序号)。
(2)请你设计一个实验,证明洗气瓶C中的Na2SO3已经被氧化(简述实验步骤): ___________________________________________________________________。
(3)若D中反应后的溶液具有漂白性,请写出D装置中发生反应的离子方程式___________________________________________________________________。
(4)该实验存在明显的缺陷,请你提出改进的方法______________________。
(5)该小组又进行了如下实验:称取漂白粉2.0 g,研磨后溶解,配制成250 mL溶液,取25 mL加入到锥形瓶中,再加入过量的KI溶液和过量的H2SO4溶液,静置。待完全反应后,用0.1 mol·L-1的Na2S2O3溶液作标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2====Na2S4O6+ 2NaI反应完成时,共用去Na2S2O320.0 mL。则该漂白粉中Ca(ClO)2的质量分数为: _________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com